Hla антигены при ревматоидном артрите
Антиген обрабатывается дендритными клетками и макрофагами, которые затем передают его В-лимфоцитам и Т-хелперам, в результате содружественной реакции которых В-лимфоциты и созревающие из них плазмоциты вырабатывают к этому антигену антитела класса IgG.
По мнению некоторых авторов, первыми антиген воспринимают и обрабатывают дендритные клетки, от которых он передается макрофагам, и лишь от них — лимфоцитам.
Следующим этапом патогенеза почти единодушно признается выработка РФ, т. е. антител к IgG. Эти антитела относятся к различным классам иммуноглобулинов, но прежде всего — к IgM.
Причины выработки аутоантител к собственному IgG неясны. Некоторые авторы полагают, что к этому приводит нарушение пространственной структуры молекулы IgG при его взаимодействии с антигеном, в связи с чем молекула воспринимается иммунокомпетентными клетками как чужеродная. Против этого предположения, однако, свидетельствует факт существования десятков заболеваний, при которых длительно вырабатываются и взаимодействуют с антигеном антитела класса IgG, но РФ не вырабатывается или представляет собой большую редкость.
Сюда относятся протеолитические ферменты (коллагеназа, эластаза, катепсины, активатор плазминогена), метаболиты арахидоновой кислоты (простагландины, простациклины, тромбоксаны, лейкотриены), токсичные дериваты кислорода, некоторые компоненты комплемента. Таким образом, на рассматриваемом этапе патогенеза заболевание впервые становится клинически очевидным, проявляясь симптомами острого артрита (синовита).
Учитывая уже рассматривавшиеся данные о роли клеточных иммунных реакции при РА и экспериментальных моделях хронического артрита, представляется весьма вероятным, что синовит развивается также в результате взаимодействия компонентов суставных тканей с сенсибилизированными к ним лимфоцитами. Не случайно в ревматоидном синовиальном экссудате определяются конкретные лимфокины, а накопление лимфоцитов в ревматоидной синовиальной мембране соответствует картине иммунной реакции замедленного типа [Zvaifler N.. 1985].
Есть серьезные основания полагать, что аутоантигеном, вызывающим развитие патогенных клеточных иммунных реакций при РА, может быть коллаген. Так, эксплантированная ревматоидная синовия отвечает усиленной продукцией лимфокинов на воздействие коллагеновых пептидов [Fisher W. et al., 1982]. Изолированные Т-лимфоциты из синовиальной мембраны также дают антигенспецифичную реакцию на коллаген [Klareskog L. et al., 1982].
Возможно, что эти антигены содержатся в основном в дендритных клетках, которые способны вызывать иммунную реакцию собственных лимфоцитов [Silver R. et al., 1983]. Некоторые наблюдения позволяют предполагать, что в течение ревматоидного процесса в синовиальной мембране могут возникать антигены, отличные от нормальных и способные поэтому вызывать клеточную иммунную реакцию [Sloan Т. et al., 1981].
Взаимодействие сенсибилизированных лимфоцитов с соответствующими аутоантигенами сопровождается продукцией биологически активных веществ (прежде всего интерлейкинов), вызывающих местный воспалительный процесс. Поэтому клеточные иммунные реакции на коллаген и компоненты синовиальной мембраны могут рассматриваться как весьма вероятные патогенетические механизмы, приводящие к развитию хронического самоподдерживающегося синовита.
Таким образом, помимо гуморальной иммунопатологии, связанной прежде всего с продукцией РФ, в развитии РА существенную, а может быть, и ведущую роль могут играть клеточные иммунные реакции. Примечательно, что коллаген, рассматривающийся выше как возможный аутоантиген в индуцировании клеточных реакций, способен вызывать и гуморальный аутоиммунный ответ — как при экспериментальном коллагеновом артрите, так и (гораздо реже) при РА у людей [Beard И. et al., 1977].
Поэтому вполне вероятно, что антитела к коллагену у небольшой группы больных играют определенную роль в качестве непосредственной причины синовита. Нельзя полностью исключить также, что именно эти антитела в то же время являются теми конкретными представителями класса IgG, к которым у отдельных пациентов вырабатывается РФ.
Все сказанное не означает абсолютной обязательности хронического течения РА. Полные клинико--лабораторные ремиссии, несмотря на их редкость, хорошо известны при этом заболевании. Возможно, что, помимо целенаправленной терапии, этому способствуют адекватные компенсаторные реакции организма — в частности, значительное нарастание в синовиальной жидкости ингибиторов медиаторов воспаления. Однако в принципе PA — хроническое прогрессирующее заболевание, характеризующееся деструкцией мягких тканей, хряща и костей. Причины разрушения хряща и кости привлекают особое внимание.
Среди медиаторов воспаления такую роль могут играть (хотя, возможно, в небольшой степени, коллагеназы нейтрофилов, макрофагов и ревматоидных синовиальных клеток. Эти ферменты могут расщеплять нативный коллаген хряща, облегчая последующую деградацию полипептидных коллагеновых цепей и протеогликанов основного вещества хряща. Показано также, что простагландины способны вызывать остеопороз, облегчая тем самым последующую деструкцию кости.
Однако основная деструкция всех компонентов ревматоидного сустава вызывается паннусом — активно пролиферирующими синовиальными клетками, образующими в своей совокупности агрессивную грануляционную ткань, способную в процессе своего роста разрушать структуры, входящие в состав сустава.
Наиболее вероятно, что первичными стимулами к агрессивной пролиферации синовиальных клеток являются вещества, продуцируемые иммунокомпетентными клетками [Korn J., 1985]. Последние вырабатывают также ангиогенный фактор, обнаруженный в синовиальной жидкости и облегчающий врастание кровеносных сосудов, которыми очень богат паннус, в хрящевую ткань [Brown R. et al., 1988]. Это обстоятельство весьма существенно, поскольку в норме хондроциты тормозят ангиогенез, вызванный лимфоцитами.
Формирование паннуса начинается обычно в синовиальных заворотах на периферии сустава, где синовиальная мембрана покрывает эпифизы сочленяющихся костей. Отсюда клетки паннуса, включая эндотелий новообразованных капилляров, врастают между коллагеновыми волокнами хряща, разрушая как собственно хрящ, так и субхондральную кость.
Механизм этой деструкции, по-видимому, связан не столько с механическим давлением паннуса, как считалось ранее, сколько с продукцией клетками паннуса больших количеств коллагеназы и простагландинов. Наиболее активны в этом отношении уже упоминавшиеся дендритные клетки синовиальной оболочки. Важно отметить, что в условиях культуры ткани выработка синовиальными клетками коллагеназы и простагландинов стимулируется интерлейкином-1, продуцируемым макрофагами, которые при РА находятся в синовиальной мембране в большом количестве.
Помимо разрушительного действия паннуса и — в гораздо меньшей степени — коллагеназ синовиальной жидкости, деструкция хряща может происходить за счет повышенной функции хондроцитов, которые при РА способны продуцировать ферменты, расщепляющие основное вещество хряща. Показано, что добавление одного из продуктов метаболизма клеток синовиальной мембраны (катаболина) или вырабатываемого макрофагами интерлейкина-1 к хондроцитам стимулирует последние к выработке простагландинов, коллагеназы и активатора плазминогена [Meats J. et al., 1980; Ridge S. et al., 1980].
Это сочетание весьма примечательно, поскольку плазмин активирует латентную коллагеназу, которая после активации вызывает распад коллагеновых волокон хряща. В то же время лимфоцитарные продукты тормозят синтез хондроцитами коллагена и гликозаминогликанов. Таким образом, содружественное влияние лимфоцитов, макрофагов и синовиоцитов на хондроциты приводит к деградации хряща путем усиления процессов распада его компонентов и одновременного торможения репарации.
Существенно, что при РА не только хрящ, но и кость могут разрушаться на расстоянии от паннуса из-за влияния продуктов, вырабатываемых иммунокомпетентными и, возможно, синовиальными клетками. L. Raisz и соавт. (1975) показали, что стимулированные в процессе иммунной реакции Т-лимфоциты вырабатывают остеокластактивирующий фактор, который повышает функцию остеокластов и тем самым увеличивает резорбцию кости.
Выделение этого фактора усиливается под влиянием простагландинов, продукция которых при РА значительно повышается различными типами клеток: макрофагами, нейтрофилами, синовиоцитами, хондроцитами. Необходимо учитывать также, что резорбция кости может происходить за счет прямого действия макрофагов [Mundy G. et al., 1977], по-видимому, вследствие содружественного влияния коллагеназы и простагландина Е2, одновременно вырабатываемых этими клетками.
Механизмы развития внесуставных проявлений РА и прежде всего нечасто встречающегося васкулита связывают в первую очередь с гуморальными иммунными нарушениями. Эта точка зрения основывается на обнаружении в стенках поврежденных сосудов иммуноглобулинов и компонентов комплемента. Кроме того, у соответствующих больных в крови часто обнаруживают умеренное снижение общей гемолитической активности комплемента (несвойственное чисто суставным формам болезни), нарастание иммунных комплексов, часто содержащих РФ, и иногда появление криоглобулинов.
Возникновение столь характерных для РА ревматоидных узелков рассматривается как местная реакция на отложение в данной области иммунных комплексов, содержащих РФ. Этому соответствует тот факт, что практически у всех больных с ревматоидными узелками в крови обнаруживают РФ. Считать ревматоидные узелки симптомом ревматоидного васкулита нет достаточных оснований, несмотря на их нередкое сочетание. По-видимому, правильнее полагать, что как узелки, так и васкулит являются нетождественным отражением высокой иммунологической активности ревматоидного процесса и поэтому часто встречаются у одного больного.
Обобщая изложенный материал, можно заключить, что ряд звеньев патогенеза РА выяснен вполне удовлетворительно. Во всяком случае реальное значение и достоверность этих патогенетических механизмов подтверждаются возможностью проведения успешных терапевтических мероприятий, основанных на вмешательстве именно в эти механизмы. Сюда относятся иммунодепрессия, лимфоцитаферез, плазмаферез, в более частных проявлениях — торможение активности простагландинов, ингибиция кислородных радикалов и т. д. В то же время создание целостного представления о патогенезе РА и уточнение всех его закономерностей явятся, по-видимому, делом не столь близкого будущего.
Ревматоидный артрит (РА) представляет собой наиболее частое воспалительное заболевание суставов. В северо-европейской популяции его встречаемость достигает более 1%. Ревматоидный артрит представляет собой системное аутоиммунное заболевание, основным признаком которого является воспаление синовиальных оболочек суставов. В отсутствии специфической терапии он характеризуется неумолимым прогрессирующим течением, хотя периоды ярких клинических проявлений чередуются с периодами относительного улучшения. Последствиями ревматоидного артрита является деградация суставного хряща, с последующей эрозией кости, приводящие к значительному разрушению сустава с потерей его функции. Кроме клиники деформирующего артрита, у 20% больных отмечаются внесуставные проявления заболевания.
Иммунологическое обследование особенно актуально на ранних стадиях болезни, когда серологическое обследование явлется единственным доступным методом объективизации клинических предположений Часто нетипичная клиническая картина в начале заболевания, например олигоартрит и отсутствие костных эрозий, несмотря на длительность жалоб пациента, а также тот факт, что применение активной терапии в дебюте заболевания может замедлить быстрое развитие деформаций суставов, делают лабораторные тесты чрезвычайно ценным инструментом дифференциальной диагностики в дебюте РА. Важно подчеркнуть, что корректный диагноз РА, поставленный на раннем этапе является основной проведения эффективной иммуносупрессивной терапии.
Ревматоидный фактор.
Дешевизна и доступность определения ревматоидного фактора (РФ) делают его первым серологическим тестом в обследовании пациентов с заболеваниями суставов. Выявление РФ в клинических лабораториях основано на использовании методов латекс-агглютинации и турбидиметрии. Хотя турбидиметрия представляет более чувствительный метод, однако ее сравнительно высокая чувствительность снижает специфичность обследования. Считаем целесообразным использовать в качестве скрининга латексный метод определения РФ, что значительно удешевляет обследование больных. При этом чувствительность латексного теста должна составлять не более 20-25 МЕ/мл. Положительные результаты латексных тестов может быть подтвержден количественными турбидиметрическими методами.Дополнительным методом серологической диагностики ревматоидного артрита является определение ревматоидного фактора (РФ) класса IgA, методом иммуноферментного анализа.
Отсутствие РФ при первом обследовании не исключает диагноза серонегативного РА. Однократное определение РФ на ранней стадии РА, принесшее отрицательный результат, недостаточно для того чтобы исключить ранний РА. Если диагноз РА подозревается или даже клинически подтвержден при отрицательном результате теста по определению РФ, требуются повторное определения его титра через 12 месяцев для определения серопозитивной формы этого заболевания. Этот срок приблизительно соответствует времени обновления пула плазматических клеток, способных синтезировать аутоантитела. Если же будет получен положительный результат, то нет реальных предпосылок повторять определение РФ с течением времени, если только не проводится биологическая терапия. В случае длительной ремиссии заболевания титры РФ снижаются ниже детектируемых. Надо отметить, что большое время полужизни сывороточного иммуноглобулина, а также постоянство иммунных ответов не позволяет использовать серологические маркеры для мониторинга течения заболевания, поэтому для мониторинга рекомендуется использовать острофазовые реактанты (СОЭ и/или СРБ), а также маркеры деструкции костной и хрящевой ткани.
Антицитруллиновые антитела.
В диагностике раннего РА необходимо всегда дополнять выявление РФ выявлением антицитруллиновых антител (АЦА). Среди антицитруллиновых антител наилучшими клинико-лабораторными параметрами обладают антитела к циклическому цитруллиновому пептиду (АЦЦП/anti-CCP) и антитела к модифицированному цитруллиннированному виментину (АМЦВ/anti-MCV) .
Наибольшей чувствительностью при обследовании пациентов всех категорий обладает совместное выявление ревматоидного фактора и антител к модифицированному цитруллинированному виментину (АМЦВ/MCV) — скрининг ревматоидного артрита. АМЦВ/MCV более чувствительный маркер ревматоидного артрита и чаще отмечается у пациентов РА серонегативных по ревматоидному фактору. При использовании сочетания РФ и анти-MCV у 85-95% больных РА удается выявить, по крайней мере, одну из разновидностей этих антител, а отсутствие всех маркеров свидетельствует об исключении диагноза РА на любом этапе этого заболевания.
Благодаря высокой специфичности наилучшими параметрами для ранней диагностики обладают антитела к циклическому цитруллиновому петиду( АЦЦП/ССР), так как их выявление имеет высокий фактор риска, т.е. его обнаружение повышает вероятность заболевания в 15 раз и обладает очень высоким предсказательным значением положительного результата. Рекомендуется использовать определение АЦЦП при проведении дифференциального диагноза ревматоидного артрита и других ревматических заболеваний (СКВ, псориатического артрита и других сернегативных артропатий, подагры).
Для оценки прогноза мы используем выявление антикератиновых антител (АКА). Ряд исследований, проведенных в нашей лаборатории, указывает на то, что АКА предсказывают развитие деструктивного процесса в суставах и пациенты с высокими титрами АКА требуют более активной иммуносупрессивной терапии. Высокоспецифическим маркером РА являются антиперинуклеарные антитела, также относящиеся к группе АЦА, выявляемые с помощью непрямой иммунофлюоресценции на субстрате пищевода крысы.
HLA генотипирование при ревматоидном артрите.
Нужно отметить, что РА ассоциирован с определенными аллелями HLA. HLA гены являются частью главного комплекса гистосовместимости и принимают активное участие в формировании иммунного ответа. Эти гены представлены в организме в гаплоидном наборе и, соответственно, могут являться гомо- или гетерозиготой. Для ранней диагностики РА необходимо выявление генов локуса HLA-DRB1. Наиболее значимыми среди них являются гены из групп DRB1*01 и DRB1*04, т.к. в экспрессированных молекулах содержат SE (общий эпитоп), презентирующий циклический цитруллинированный пептид клеткам иммунной системы. У больных РА, несущих гены группы DRB1*01, а именно аллельный ген DRB1*01:01, который составляют 86% от аллельной группы чаще развивается серопозитивный РА с быстрой деструкцией суставов. Наличие этого гена в геноме обязательно, однако недостаточно для развития серопозитивного РА у человека. Группа аллельных генов HLA-DRB1*01 отмечается у 29% пациентов с серопозитивным РА, сопровождающимся антителами к цитруллированным антигенам и ревматоидному фактору.
Степень деструкции хряща.
Определение концентрации хрящевого олигомерного белка (СОМР) позволяет оценить степень деструкции хряща. Сывороточная концентрация СОМР может использоваться как ранний и перспективный маркер ремоделирования суставного хряща. Высокие концентрации COMP указывают на быструю деструкцию хрящевой ткани при остеартрите и других хронических артритах. Исследование уровня СОМР следует использовать при мониторинге эффективности терапии ревматоидного артрита и остеоартроза. Одновременное определение маркеров хрящевой деструкции и воспаления позволяет проводить адаптировать терапию заболеваний суставов с учетом варианта поражения и скорости разрушения суставного хряща.
В качестве дифференциального диагноза диагноза РА часто рассматриваются серонегативные спондилоартропатии.
Серонегативные спондилоартропатии.
Продукты генов системы HLA (человеческие лейкоцитарные антигены), расположенной на 6 хромосоме, захватывают и представляют чужеродные антигены в иммунной системе, что приводит к запуску специфических иммунных ответов. Гены этой системы отличаются разнообразием, что обеспечивает контроль всех иммунных ответов, в том числе аутоиммунных. Причиной индукции ряда аутоиммунных заболеваний являются определенные аллели (варианты) генов системы HLA, которые перекрестно презентируют экзогенные анитигены аутореактивным лимфоцитам.
Кристаллопатии и подагра.
Нарушение обмена пуриновых оснований в организме при подагре приводит к повышению содержания мочевой кислоты в крови и синовиальной жидкости. Острый приступ подагрического артрита сопровождается кристаллизацией солей с образованием кристаллов моноурата натрия. Прямое обнаружение кристаллов возможно при проведении исследования суставной жидкости. Тонкие игловидные кристаллы моноурата натрия могут быть расположены внутри и внеклеточно. При исследовании в поляризованном свете они могут быть идентифицированы благодаря характерному отрицательному двойному лучепреломлению.
Другой формой микрокристаллического артрита является псевдоподагра, которая сопровождается формированием кристаллов пирофосфата кальция. Кристаллы образуются под действием фермента нуклеозидтрифосфат пирофосфорилазы, который при остеоартрозе синтезируется в суставном хряще. В отличии от моноурата натрия, кристаллы пирофосфота кальция при пирофосфатной артропатии, толще и короче, ромбовидной формы и обладают положительным двойным лучепреломлением.
by Maija Mukāne · 20 апреля, 2016

Д-р, интернист, Рижский университет им. П. Страдиня, стационар Гайльэзерс Рижской Восточной университетской клинической больницы, ОЦЗ Аура

Боль в суставах и отек, одеревенелость, ограничения в движениях – если у вас эти симптомы длятся больше двух недель, пора обратиться к врачу. Эти признаки указывают на воспаление суставов – артрит.
Среди пожилых пациентов самой частой причиной воспаления суставов является остеоартрит, а среди молодых пациентов причиной могут быть другие типы артрита (например, ревматоидный артрит или артрит у пациентов с псориазом). После беседы и осмотра врач предполагает возможные диагнозы, но для подтверждения многих из них зачастую необходимо сдать кровь на анализ или провести другие обследования (например, рентгенограмму или обследование методом магнитного резонанса).
В случае остеоартрита показатели крови зачастую не изменены, а при других видах артрита может быть повышен уровень показателей воспаления и разных специфических антител, других показателей. В данной статье опубликована информация о показателях в анализах, при помощи которых можно диагностировать и определить тип артрита. Своевременно определив тип воспаления сустава, можно вовремя начать лечение и уменьшить объем поражения сустава.
Врач, который поможет определить природу поражения сустава, т. е. тип артрита, – ревматолог. Этот специалист чаще всего направляет пациентов на дополнительные анализы. При артрите определяются следующие показатели.
- ревматоидный фактор;
- антитела к циклическому цитруллинированному пептиду, или АЦЦП;
- скорость оседания эритроцитов, или СОЭ;
- С-реактивный белок, или СРБ;
- антинуклеарные антитела, или АНА;
- уровень мочевой кислоты;
- наличие антигена HLA-B27 в крови.
Ревматоидный фактор
Антитела к циклическому цитруллинированному пептиду, или АЦЦП
Скорость оседания эритроцитов, или СОЭ
Скорость оседания эритроцитов – это один из показателей воспаления. В случае артрита в суставах происходит хроническое, постоянное воспаление, которое усугубляется при обострениях или прогрессировании болезни. Поэтому для оценки эффективности медикаментов и активности заболевания определяют уровень показателей воспаления, т. е. скорость оседания эритроцитов. Нужно учесть, что показатели воспаления не являются специфическими для определенного вида поражения сустава и, судя только по этим показателям, врач не может определить причину поражения сустава (например, артрит у пациента с псориазом или волчанкой).
С-реактивный белок, или СРБ
С-реактивный белок, или С-реактивный протеин, – это специфический белок, который вырабатывает печень и уровень которого увеличивается при остром воспалении или инфекции. Так же как и скорость оседания эритроцитов, С-реактивный белок не является специфическим показателем поражения суставов – он указывает на выраженность воспалительного процесса (например, у пациентов с воспалением легких С-реактивный белок будет сильно повышен, а у пациентов с ревматоидным артритом его уровень увеличится, только если есть всплеск, или обострение, заболевания). По этому показателю можно судить об эффективности применяемых в лечении медикаментов: если на фоне лечения уровень С-реактивного белка понижается, то это означает, что активность воспаления в суставах снизилась и, следовательно, поражение суставов не прогрессирует. Поэтому ревматолог может часто назначать этот анализ, чтобы определить выраженность воспаления в суставах.
Следует учесть, что уровень С-реактивного белка в анализе крови быстрее снизится в результате лечения, но скорость оседания эритроцитов может еще некоторое время оставаться повышенной.
Антинуклеарные антитела, или АНА
Антинуклеарные антитела вырабатываются клетками иммунной системы при разных ревматологических и аутоиммунных заболеваниях, и они действуют против здоровых клеток. Количество антител может быть разным, поэтому, если у вас в крови найдены антинуклеарные антитела, лаборатория определяет их количество. Существуют разные виды антинуклеарных антител, и врач назначит, какие именно требуется определить.
Антинуклеарные антитела могут быть найдены и у здорового пожилого человека, а также некоторые медикаменты могут вызывать повышение уровня этих антител.
Уровень мочевой кислоты
Мочевая кислота образуется в организме из пуринов, которые находятся почти во всех клетках организма и продуктах питания. Пурины широко распространены, потому что являются химической составляющей генов. У здоровых людей из пуринов образуется мочевая кислота, которая затем выводится из организма.
Если по какой-то причине мочевая кислота не выводится из организма (например, у пациентов с хронической болезнью почек), она накапливается в организме и может образовывать кристаллы, которые оседают в суставах и вызывают подагрический артрит. Для того чтобы подтвердить или исключить подагрический артрит, определяется уровень мочевой кислоты в крови.
Наличие антигена HLA-B27 в крови
Антиген HLA-B27 в крови является специфическим генетическим маркером, уровень которого определяется один раз в жизни (результат может быть положительным или отрицательным и не меняется в течение жизни). Обнаружена связь этого маркера с ревматологическими заболеваниями, и результат этого анализа поможет ревматологу поставить диагноз. У пациентов с антигеном HLA-B27 выше риск заболеть, например, артритом при псориазе, ревматоидным артритом в молодом возрасте, т. е. ювенильным ревматоидным полиартритом, или анкилозирующим спондилоартритом.
Выводы
Воспаление суставов, или артрит, могут вызвать различные заболевания, но чаще всего – ревматологические. Своевременно диагностировав артрит и определив его тип, исходя из жалоб пациента, результатов осмотра, анализов крови и других обследований, можно вовремя начать лечение и снизить риск осложнений, в том числе инвалидизирующих.
Как правильно сдавать анализы?
За день до сдачи анализов желательно не употреблять жирную пищу. Анализы необязательно сдавать натощак.
Ревматоидный артрит представляет собой системное иммуновоспалительное заболевание соединительной ткани, проявляющееся хроническим эрозивно-деструктивным полиартритом с преимущественно симметричным поражением суставов кистей и стоп и сопровождающееся у бо
Ревматоидный артрит представляет собой системное иммуновоспалительное заболевание соединительной ткани, проявляющееся хроническим эрозивно-деструктивным полиартритом с преимущественно симметричным поражением суставов кистей и стоп и сопровождающееся у большинства больных образованием особого вида аутоантител (ревматоидный фактор). Женщины болеют в 3–4 раза чаще мужчин, причем заболевание у них начинается обычно в возрасте 35–45 лет.
Болезненные, тугоподвижные суставы не только мешают выполнять самые простые повседневные движения, но и значительно нарушают ритм нормальной жизни.
Ревматоидный полиартрит — тяжелое системное заболевание, которое проявляется прогрессирующим воспалительным синовитом, симметрично поражающим периферические суставы конечностей.
В соответствии с рекомендациями Американской ревматологической ассоциации (1987) при диагностике ревматоидного артрита целесообразно придерживаться следующих критериев:
- утренняя скованность суставов или вблизи суставов длительностью не менее 1 ч до ее полного исчезновения;
- опухание мягких тканей (артрит) трех суставов или более, наблюдаемое врачом (т. е. в период осмотра или в анамнезе под наблюдением врача);
- опухание (артрит) проксимальных межфаланговых, пястно-фаланговых или запястных суставов;
- симметричное опухание (артрит) как минимум в одной паре суставов;
- ревматоидные узелки;
- наличие ревматоидного фактора;
- обнаружение при рентгенологическом исследовании эрозий и (или) периартикулярного остеопороза в суставах кистей и стоп.
При длительно текущем заболевании деформируются пораженные суставы. Помимо суставов, при ревматоидном полиартрите нарушаются околосуставные структуры (связки, сухожилия и др.), развиваются ревматоидный васкулит (поражение мелких сосудов), остеопороз, происходит поражение внутренних органов.
В пользу иммунопатологического/аутоиммунного характера воспалительного процесса при ревматоидном артрите свидетельствует обнаружение у большинства больных в сыворотке крови и синовиальном выпоте из пораженных суставов аутоантител — ревматоидного фактора.
Большое значение в развитии ревматоидного артрита имеет генетическая предрасположенность. Это подтверждается выраженной семейной агрегацией заболевания, наличием у части больных ревматоидным артритом антигенов II класса главного комплекса гистосовместимости HLA DR4 и Dw4 (с носительством которых связывают тяжелое течение артрита и быстрое прогрессирование эрозивных изменений суставов). Рассматривается роль наследственных или приобретенных нарушений Т-супрессорной регуляции иммунных реакций, недостаточной функции моноцитарно-макрофагальной системы. Пусковую роль в развитии ревматоидного артрита могут играть: хронические очаги инфекции, гормональная перестройка организма, пищевая аллергия, предшествующие травмы суставов, длительное воздействие влажного холода и физическое перенапряжение.
При хроническом воспалении у края суставного хряща в месте прикрепления к эпифизам суставной капсулы происходит разрушение и замещение паннусом участков субхондральной костной ткани с образованием эрозий. Иногда разрастающиеся грануляции проникают через субхондральную замыкательную пластинку в костную ткань. Продукты костно-хрящевой деструкции, в свою очередь, оказывают раздражающее воздействие на синовиальную оболочку, что способствует поддержанию в ней воспалительного процесса. Одновременно возникают воспалительные изменения в капсуле сустава, связках, синовиальной выстилке сухожилий и синовиальных сумках с последующим их склерозированием, приводящему к стойкому ограничению подвижности пораженных суставов, подвывихам и контрактурам. Иногда наблюдается некроз и разрыв сухожилий, синовиальных сумок. Нередко отмечается развитие вторичного остеоартроза.
Воспалительный процесс при ревматоидном артрите характеризуется неуклонным прогрессированием, темпы которого зависят от активности воспалительного процесса. Даже в периоды клинической ремиссии в синовиальной оболочке сохраняются признаки воспаления. Постепенно паннус разрушает хрящ на значительной поверхности эпифиза, а замещающая его грануляционная ткань соединяет между собой противоположные суставные поверхности и в последующем трансформируется вначале в фиброзную, а затем в костную ткань, что приводит к образованию соответственно фиброзного и костного анкилоза, обусловливающего полную неподвижность пораженных суставов.
При рентгенологическом исследовании суставов отмечается асимметричность эрозивных изменений с частым и ранним анкилозированием суставов запястий.
Течение серонегативного ревматоидного артрита менее тяжелое, в прогностическом плане более благоприятное, чем при серопозитивной форме заболевания: слабее выражены деструктивные (эрозивные) изменения и функциональные нарушения суставов, реже наблюдаются ульнарная девиация пальцев кистей, контрактуры и анкилоз (за исключением анкилоза суставов запястья). Вместе с тем серонегативный ревматоидный артрит хуже, чем серопозитивный, поддается терапии базисными и иммуносупрессивными препаратами. Чаще развивается вторичный амилоидоз.
При лечении ревматоидного артрита используются НПВП, в тяжелых случаях применяются глюкокортикостероиды, иммуносупрессоры, с целью профилактики остеопороза обычно назначают комбинацию препаратов кальция и витамина D.
Несмотря на все успехи фармакологии, ревматоидный артрит до настоящего времени остается тяжелым заболеванием с неблагоприятным прогнозом.
Приведем пример из личного опыта ведения больной с ревматоидным артритом, представляющим, по мнению автора, научный интерес.
Больная В., возраст — 71 год, обратилась к неврологу в августе 2006 г. с жалобами на боли в суставах кистей, коленных суставах, в пояснице. Боль в суставах беспокоила днем и ночью, обычно была выраженной, нередко мигрирующей, обусловливала ограничение всех активных и пассивных движений в пораженных суставах. Артралгия зачастую сочеталась с выраженной миалгией, оссалгией, болями в сухожилиях. Из анамнеза: проявления полиостеоартроза в течение 15 лет, дебют суставного синдрома воспалительного характера в июне 2002 г. (отек и воспаление в области суставов, фебрильная лихорадка, подтвержденная лабораторно активность воспалительного процесса). Амбулаторно (сначала периодически, в последние 3 года постоянно) получала НПВП (ибупрофен, индометацин, диклофенак, ацеклофенак). С 2004 г. регулярно принимала кальций D3 (1 г кальция в сутки).
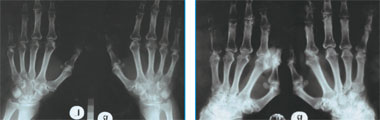 |
| Рис. 1. Рентгенограмма кистей больной В. 2003 г.: проявления полиостеоартроза, явных эрозий нет. Рис. 2. Рентгенограмма кистей больной В. 2006 г.: множественные кисты и эрозии, отрицательная динамика с 2003 г. |
Стационарно проходила лечение в городском ревматологическом центре г. Санкт-Петербурга (апрель 2003 г., июнь–июль 2006 г.) с диагнозом: ревматоидный артрит, серопозитивный, с системными проявлениями (субфебрилитет, амиотрофия, миалгии), активность 2-й степени, функциональная недостаточность суставов 1–2-й степени. Сопутствующая патология: ишемическая болезнь сердца, стенокардия II ФК. Гипертоническая болезнь 3-й степени, ОНМК (декабрь 2002 г.). Хронический бронхит вне обострения. Диффузный зоб второй стадии. Эутиреоз. Полиостеоартроз. Желчно-каменная болезнь.
С 2003 г. постоянно получает метотрексат в дозировке 2,5 мг 2 раза в неделю. Несмотря на проводимое лечение, суставной болевой синдром нарастал, учащались обострения, ухудшалось состояние костей (остеопороз, эрозии). Показательна рентгенография кистей (рис. 1–2).
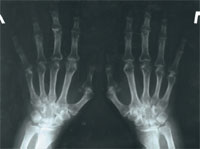 |
| Рис. 3. Рентгенограмма кистей больной В. 2007 г.: проявления полиостеоартроза, положительная динамика с 2006 г. |
С августа 2006 г. на фоне лечения метотрексатом неврологом был дополнительно назначен Структум в дозировке 500 мг 2 раза в день. Больная ориентирована врачом на длительный, до полугода, прием препарата. Некоторое уменьшение интенсивности (непрекращающегося в течение 2 последних месяцев) болевого синдрома наступило через 3 нед. Эпизоды обострений ревматоидного артрита были в течение 4 мес. К концу 5-го месяца комбинированной терапии (метотрексат + Структум) болевой синдром значительно снизился, уменьшилась утренняя скованность, спала отечность лучезапястных и коленных суставов.
В феврале 2007 г. была сделана рентгенография кистей (рис. 3). Результат сравнения с предыдущими рентгенографиями оказался более чем положительным (уменьшились эрозии костей). Прием структума продлен на 3 мес. По состоянию на май 2007 г. обострений суставного синдрома не наблюдалось в течение 4 мес, сохранялась небольшая отечность на лучезапястных (больше слева) и коленных суставах. С целью коррекции противоревматической терапии (снижение дозы метотрексата) больной рекомендована консультация в городском ревмоцентре.
И. Н. Бабурин
СПбНИПНИ им. В. М. Бехтерева, Санкт-Петербург
Читайте также:


