Фактор некроза опухоли альфа при ревматоидном артрите


Автореферат диссертации по медицине на тему Ревматоидный артрит: фактор некроза опухоли альфа при различных клинических вариантах болезни и его динамика в процессе лечения
На правах рукописи
РЕВМАТОИДНЫЙ АРТРИТ: ФАКТОР НЕКРОЗА ОПУХОЛИ АЛЬФА ПРИ РАЗЛИЧНЫХ КЛИНИЧЕСКИХ ВАРИАНТАХ БОЛЕЗНИ И ЕГО ДИНАМИКА В ПРОЦЕССЕ ЛЕЧЕНИЯ
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Ярославской государственной медицинской академии Министерства здравоохранения Российской
Научный руководитель доктор медицинских наук,
профессор КОРШУНОВ Николай Иванович
Официальные оппоненты доктор медицинских наук,
профессор БАРАНОВ Андрей Анатольевич
доктор медицинских наук, профессор БАБАЕВА Аида Руфатовна
Ведущая организация ГУ Институт ревматологии РАМН
Защита диссертации состоится 15 марта 2005 г. в _час. на
Ученый секретарь диссертационного сонета
на уровне клеточных воспалительных pea
ИТ П НТГ МУЧИЧТПрПП
РОС НАЦИОНАЛЬНАЯ БИБЛИОТЕКА
ФНО 5,4 ± 1,06* 10,1 ±3,31* 4,9 ±2,92* 8,9 ±3,14*
Степень активности минимальная умеренная высокая
ФНО 14,3 ± 6,97 6,2 ± 1,60* 9,2 ±1,90*
Уровень гемоглобина в крови (г/л)
п п 57 п 52 п 127
ФНО 13,1 ± 3,68* 6,8 ±1,85* 4,9 ± 1,75
Стадия болезни 1 -II III - IV
ФНО 6,6 ± 2,34 7,6 ±1,90*
Внесусгав. проявления Нет Есть
ФНО , 4,7 ±1,07 10,0 ±2,28*
Гормонозависимость Нет Есть
ФНО 6,2 ± 1,68 9,5 ±2,81*
* - р 24 из 57 - 42,1%
Рис. 1 Число случаев с повышенным уровнем ФНО (более 5.1 пг/мл) в зависимости от уровня гемоглобина
ГЗ- 43 из 152-28,3% 36 из 84 - 42,9%
р 5,1 пг/мл в зависимости от наличия гормонозависимости
Число случаев с превышающим норму уровнем ФНО достоверно выше в группе больных с анемией (менее 110 г/л уровнем гемоглобина), чем при сохраненном (более 120 г/л) уровне гемоглобина (рис. 1). Безусловно, это более тяжелые больные, у которых анемия выступает и как показатель активности, и как системное проявление. Более тяжелыми представляются гормонозависимые больные, среди которых число с повышенным уровнем ФНО достоверно выше, чем среди пациентов с отсутствием гормонозависи-мости (рис. 2).
Таким образом, можно сказать, что содержание ФНО в сыворотке крови больных РА отражает агрессивную роль этого цитокина в становлении более тяжелых форм болезни. Однако, это общее заключение, отражающее объективные патогенетические механизмы, реализующие иммунопатологический процесс, лежащий в основе болезни, по-видимому, на сегодняшний день не может быть использовано в широкой ревматологической практике. Слишком вариабельны значения ФНО у отдельных больных: даже при высо-
кой активности болезни и наличии внесуставных поражений содержание ФНО может быть низким и даже нулевым, а при низкой активности - высоким. Подобные ситуации могут быть рассмотрены с точки зрения его реального дефицита в сыворотке вследствие потребления рецепторным аппаратом клеток (в некоторых случаях высокой активности) или с точки зрения функционирования всей обширной цитокиновой сети, с большим количеством не только лровоспалительных, но и противовоспалительных цитокинов, вырабатывающихся в ответ на продукцию того же ФНО (в некоторых случаях невысокой активности). Возможны многочисленные комбинации про- противовоспалительного действия многочисленных и взаимосвязанных элементов цитокиновой сети, которых насчитывается много десятков, поэтому сегодня даже одновременное исследование нескольких цитокинов по-видимому не всегда может решить ряд практических диагностических задач. Следует признать, что, позволяя в определенной мере понять закономерности воспалительного процесса в целом, конкретные значения ФНО у конкретного больного пока мало помогают в диагностической и по-видимому, прогностической и терапевтической ориентации.
трольное исследование. Практически все больные были с достаточно высокой активностью процесса, резистентной к терапии метотрексатом. После первой инфузии препарата четкий противовоспалительный эффект был достигнут у всех, в дальнейшем, в разные сроки (6-я, 14-я, 30-я недели) наблюдался возврат клинических проявлений в виде некоторого увеличения числа воспаленных и болезненных суставов, однако, спустя 12 месяцев клинический эффект был достигнут у всех, хотя и в разной степени. Лишь у одного больного тяжесть состояния и по оценке самого пациента, и по оценке врача, осталась прежней. Динамику СОЭ в течение года у трех больных можно расценить как положительную, у двух СОЭ не было персистирующе высокой, но отмечались колебания от субнормальных цифр до высоких (от 25 до 50мм/час), в том числе и на 64 неделе наблюдения. Таким образом, клинический эффект несомненен, однако, указанные колебания активности на фоне лечения ремикейдом подтверждают необходимость дальнейших поисков оптимального режима применения препаратов этой группы. Сами по себе эти колебания (особенно эффект первого введения!) демонстрируют возможность эффективного подавления воспалительного процесса даже у тяжелых и резистентных к терапии больных. И, возможно, дело не только и не столько в необходимости повышения дозы, как считают некоторые, сколько в оптимальном сочетании с цитостатюсами или другими базисными средствами, или глюкокортикоидами, или даже другими средствами биологической терапии, которые могут нивелировать появление вторичных иммунных реакций на введение препарата, индуцирующих рецидив всех клинических проявлений болезни. Очевидно, что это, хотя и чрезвычайно затратное, но важное направление будущих научных исследований.
Динамика среднего уровня сывороточного ФНО в процессе лечения ремикейдом в нашем исследовании демонстрировала поступательное снижение от недели к неделе. Через 12 месяцев ни у одного больного ФНО в крови не определялся. Однако, на основании подобной динамики у 5 больных, разумеется, нельзя делать далеко идущих обобщающих выводов. Это тем более так, поскольку активность процесса еще сохранялась (у одного больного достаточно высокая), а реальную возможность низких цифр при этом мы уже обсуждали.
Клиническая характеристика больных РА
Признак С использованием Без использования
Пол. мужчины 4 4
Возраст: 20-39 8 6
60 лет и старше 8 6
Давность заболевания: до 2 лет 3 2
более 10 лет 12 15
Наличие системных проявлений 18 12
Вариант: серопозитивный 28 29
серонегативный 9 8
Стадия болезни: I - П 12 6
Функциональный класс: I 4 0
Во всех трех сравниваемых группах можно отметить преимущество • назначения артрофоона. Оно выразилось в том, что лишь в тех группах больных, где он назначался, отмечалось достоверное по сравнению с исходным снижение ряда основных клинических показателей, указывающих на степень активности патологического процесса, а именно: визуальной анало-I овой шкалы боли, числа воспаленных суставов и величины суставного индекса. И хотя попарное сравнение динамики средних величин этих показателей между собой (в основной и контрольной группах) аакой закономерной разницы не установило, использование непараметрических методов статистики подтверждает существование достоверных различий в группах в отношение некоторых из них. Так, в соответствии с критерием Вилкоксона выявлена существенные различия в динамике визуальной шкалы боли' к шестому месяцу терапии ее снижение было более демонстративным у лиц, получавших монотерапию артрофооном по сравнению с контрольной 1руп-пой лиц, лечившихся НПВС. (для 22 пациентов двух групп и - 20; р 5,1 Через !мес. ФНОгп/м; Число б-ых сФНО>5,1 Через бмес. ФНОпг/ш число б-ых с ФНО>5,1
НПВС 10 3,2±1,64 2(20,0%) 4,6±1,64 3(30,0%) 5,0±1,74 3(30,0%)
Арт. 11 2,2±0,62 2(18,2%) 18,5+10,96 2(18.2%) 4,8±3,80 1(9,1%)
Арт.+НПВС 15 9,3±7,89 3(20,0%) 4,0±3,07 2(13,3%) 6,0±1,03 3(20,0%)
Арт.+НПВС - Эйд, Риад :: 2005 :: Ярославль
Глава 1 Ревматоидный артрит. Иммунные механизмы воспаления. Роль фактора некроза опухоли альфа в развитии болезни. Антицитокиновая (анти-ФНО) терапия
Глава 2 Клиническая характеристика и методы обследования больных
Глава 3 Содержание ФНО в крови больных ревматоидным артритом при различных клинических вариантах болезни.
Глава 4 Эффективность анти-ФНО гибридных моноклональных антител (Ремикейд) в терапии больных ревматоидным артритом
Глава 5 Содержание ФНО в сыворотке крови больных ревматоидным артритом в процессе лечения ремикейдом
Глава 6 Артрофоон в лечении больных ревматоидным артритом.
Глава 7 Динамика содержания ФНО в сыворотке крови больных ревматоидным артритом в процессе лечения с использованием артрофоона
Глава 8 Гамма-плант в терапии больных ревматоидным артритом.
Глава 9 Динамика содержания ФНО в сыворотке крови у больных ревматоидным артритом в процессе лечения гамма-плантом
Введение диссертации по теме "Ревматология", Эйд, Риад, автореферат
Трудно переоценить социальное значение ревматических болезней, которые в этой связи объявлены ВОЗ как приоритетная патология в первой десятилетии XXI века [35, 36, 50, 160 ]. Среди них ревматоидный артрит является одной из наиболее распространенных и встречается в популяции с частотой около 1%- [2, 56]. Медицинское и социальное значение ревматоидного артрита определяется многими факторами. Во-первых, прогрессирование деструктивного артрита и нарушение функции суставов приводит к снижению качества жизни и ранней инвалидизации больных [35]; во-вторых, возникновение у ряда больных внесуставных проявлений может приводить к тяжелым функциональным нарушениям, что вместе с осложнениями противоревматической терапии ведет к укорочению продолжительности жизни у этих больных [82,122,129,170].
В настоящее время РА рассматривается, как наиболее яркий прототип заболеваний, в основе развития которых лежит хроническое воспаление [32].
Цель исследования: Оценить диагностическую значимость ФНО-а при различных клинических вариантах РА и его динамику в процессе лечения некоторыми новыми противовоспалительными средствами в сопоставлении с динамикой клинико-лабораторных проявлений болезни.
1. Изучить содержание ФНО-а у больных РА в зависимости от ряда клинических характеристик болезни: степени активности процесса, системности поражения и характера внесуставных проявлений болезни, функциональной активности больного.
Изучение содержания ФНО у больных РА в различных клинических ситуациях позволило оценить роль этого цитокина в становлении различных вариантов болезни, в частности тяжелых ее форм, протекающих с анемией и гор-монозависимостыо; но в то же время, продемонстрировав большую индивидуальную вариабельность, показало необходимость критического подхода к диагностической значимости его определения в сыворотке крови в отдельных конкретных случаях. Показана клиническая эффективность не только известных препаратов биологической терапии, представляющих моноклональные антитела к ФНО (ремикейд), но и аффинно-очищенных антител к ФНО в сверхмалых дозах (препарат Артрофоон), а также нового препарата Гамма-плант, представляющего гликопротеин растительного происхождения.
Установлено, что аффинно-очищенных антитела в сверхмалых дозах (препарат артрофоон) в случаях невысокой (минимальной или некоторых случаях умеренной) активности ревматоидного артрита при сублингвальном приеме могут быть безопасной альтернативой противовоспалительной терапии НПВС или могут быть использованы для оптимизации эффекта как дополнение к уже проводимой, но недостаточно эффективной терапии НПВС или метот-рексатом. Установлено, что в случаях недостаточно эффективной терапии НПВС и базисных средств может быть использовано дополнительное парентеральное применение препарата Гамма-плант. Динамика сывороточного содержания ФНО в большинстве случаев не коррелирует с динамикой клинических данных.
Основные положения выносимые на защиту :
1. Уровень сывороточного ФНО хотя и связан с некоторыми клиническими характеристиками болезни (анемия, гормонозависимость), но не может являться безоговорочным критерием активности процесса или эффективности терапии.
2. Аффинно-очищенных антитела к ФНО в сверхмалых дозах и препарат гамма-плант (гликопротеин растительного происхождение) у больных ревматоидным артритом оказывают противовоспалительный эффект.
Аннотация научной статьи по фундаментальной медицине, автор научной работы — Чичасова Наталия Владимировна
Для лечения ревматических заболеваний ревматоидного артрита (РА), анкилозирующего спондилита, псориатического артрита в 2012 г. в России зарегистрирован ингибитор фактора некроза опухоли (ФНО) α голимумаб (ГЛМ), который представляет собой полностью человеческое моноклональное антитело. Его отличительными чертами являются высокая аффинность к ФНОα, а также удобство применения: препарат вводится 1 раз в месяц подкожно в виде раствора, объемом 0,5 мл. Регистрации препарата предшествовало проведение массивной программы клинических исследований. Рандомизированные плацебоконтролируемые исследования GO-FORWARD, GO-BEFORE, GO-AFTER показали, что ГЛМ эффективен у пациентов с РА из различных подгрупп и обладает благоприятным профилем безопасности, соответствующим таковому всего класса генно-инженерных биологических препаратов . По данным этих исследований, ГЛМ оказывал позитивное влияние на функцию и качество жизни больных РА: отмечено достоверно большее снижение индекса HAQ как в ранние сроки лечения, так и на протяжении длительной открытой фазы (до 5 лет), достоверно большее уменьшение утомляемости, достоверно большее, чем в контрольной группе (р=0,032), улучшение физического и ментального состояния по опроснику SF-36, достоверное уменьшение времени нетрудоспособности.
Похожие темы научных работ по фундаментальной медицине , автор научной работы — Чичасова Наталия Владимировна
The tumor necrosis factor-α inhibitor golimumab in the treatment of rheumatoid arthritis
The tumor necrosis factor-α (TNF-α) golimumab (GLM), that is a fully human monoclonal anti-body, was registered in Russia in 2012 to treat rheumatic diseases, such as rheumatoid arthritis (RA), ankylosing spondylitis, and psoriatic arthritis. Its distinguishing characteristics are a high affinity for TNF-α and easiness-to-use: the drug as a 0.5-ml solution is injected subcutaneously once monthly. The registration of the medication was followed by the implementation of a massive program of clinical trials. The randomized placebo-controlled GO-FORWARD, GO-BEFORE, and GO-AFTER studies have indicated that GLM is effective in patients with RA from different subgroups and has a favorable safety profile as compared to that of the entire class of biological agents . According to the data of these studies, GLM had a positive effect on the functional status and quality of life in patients with RA: there was a significantly greater decrease in HAQ scores in both the early and long open treatment phases (to 5 years) and in fatigability than in the control group (p=0.032), physical and mental health improvements, as shown by the SF-36 questionnaire, and a significant reduction in disability.
Ингибитор фактора некроза опухоли а голимумаб в лечении ревматоидного
105043, Москва, ул. Б. Пироговская, д. 2, стр. 4
Для лечения ревматических заболеваний — ревматоидного артрита (РА), анкилозирующего спондилита, псориатического артрита — в 2012 г. в России зарегистрирован ингибитор фактора некроза опухоли (ФНО) а голимумаб (ГЛМ), который представляет собой полностью человеческое моноклональное антитело. Его отличительными чертами являются высокая аффинность к ФНОа, а также удобство применения: препарат вводится 1 раз в месяц подкожно в виде раствора, объемом 0,5 мл. Регистрации препарата предшествовало проведение массивной программы клинических исследований. Рандомизированные плацебоконтролируемые исследования GO-FORWARD, GO-BEFORE, GO-AFTER показали, что ГЛМ эффективен у пациентов с РА из различных подгрупп и обладает благоприятным профилем безопасности, соответствующим таковому всего класса генно-инженерных биологических препаратов. По данным этих исследований, ГЛМ оказывал позитивное влияние на функцию и качество жизни больных РА: отмечено достоверно большее снижение индекса HAQ как в ранние сроки лечения, так и на протяжении длительной открытой фазы (до 5лет), достоверно большее уменьшение утомляемости, достоверно большее, чем в контрольной группе (р=0,032), улучшение физического и ментального состояния по опроснику SF-36, достоверное уменьшение времени нетрудоспособности.
Ключевые слова: ревматоидный артрит; базисные противовоспалительные препараты; генно-инженерные биологические препараты; голимумаб.
Контакты: Наталия Владимировна Чичасова; kafedrarheum@yandex.ru
Для ссылки: Чичасова НВ. Ингибитор фактора некроза опухоли а голимумаб в лечении ревматоидного артрита. Современная ревматология. 2014;(4):76—85.
The tumor necrosis factor-a inhibitor golimumab in the treatment of rheumatoid arthritis
I.M. Sechenov First Moscow State Medical University, Ministry of Health of Russia, Moscow, Russia 2, B. Pirogovskaya St., Build. 4, Moscow 105043
The tumor necrosis factor-a (TNF-a) golimumab (GLM), that is a fully human monoclonal anti-body, was registered in Russia in 2012 to treat rheumatic diseases, such as rheumatoid arthritis (RA), ankylosing spondylitis, and psoriatic arthritis. Its distinguishing characteristics are a high affinity for TNF-a and easiness-to-use: the drug as a 0.5-ml solution is injectedsubcutaneously once monthly. The registration of the medication was followed by the implementation of a massive program of clinical trials. The randomized placebo-controlled GO-FORWARD, GO-BEFORE, and GO-AFTER studies have indicated that GLM is effective in patients with RA from different subgroups and has a favorable safety profile as compared to that of the entire class of biological agents. According to the data of these studies, GLM had a positive effect on the functional status and quality of life in patients with RA: there was a significantly greater decrease in HAQ scores in both the early and long open treatment phases (to 5 years) and in fatigability than in the control group (p=0.032), physical and mental health improvements, as shown by the SF-36 questionnaire, and a significant reduction in disability..
Key words: rheumatoid arthritis; disease-modifying antirheumatic drugs; biological agents; golimumab. Contact: Natalia Vladimirovna Chichasova; kafedrarheum@yandex.ru
For reference: Chichasova NV. The tumor necrosis factor-a inhibitor golimumab in the treatment of rheumatoid arthritis. Modern
Rheumatology Journal. 2014;(4):76—85.
Ревматоидный артрит (РА) — хроническое аутоиммунное заболевание, характеризующееся персистированием синовиального воспаления с последующим разрушением хряща и кости, приводящим к снижению функциональной способности больных [1, 2]. В патогенезе РА участвуют иммунные эффекторные клетки и цитокины, регулирующие воспалительные процессы [3, 4]. В настоящее время в лечении РА центральное место занимают традиционные синтетические базисные противовоспалительные препараты (БПВП), такие как метотрексат (МТ), но гетерогенность популяции больных РА влияет на их эффективность и переносимость,
Рис. 1. Тактика лечения больного с ранней стадией РА. ЛЕФ
тием структурных повреждений. В реальной практике частота посещений больным ревматолога определяется вариантом течения РА: устойчивостью активности болезни и скоростью прогрессирования деструкции. Общеевропейский опрос ревматологов (п=457) показал, как врачи подходят к лечению конкретного больного в повседневной практике [6]: 40% респондентов сообщили, что при ежемесячном осмотре видят пациентов преимущественно с быстрым про-грессированием болезни, только 3% респондентов наблюдают пациентов преимущественно со стабильной болезнью. Очевидно, что для больных с быстрым прогрессированием РА нужна интенсификация стратегии лечения, в том числе раннее использование генно-инженерных биологических препаратов (ГИБП). Это нашло отражение в рекомендациях EULAR 2010 и 2013 г.: при наличии прогностически неблагоприятных факторов, таких как высокая активность болезни, позитивность по ревматическому фактору (РФ) и/или антителам к циклическому цитруллинированному пептиду (АЦЦП), прогрессирование структурных повреждений, ГИБП могут быть назначены, если не достигнута низкая ак-
лефлуномид, СУЛЬФ — сульфалалазин, ГК — глюкокортикоиды
тивность или ремиссия РА после применения первого БПВП (рис. 1) [7, 8].
Успехи в изучении патогенеза РА в последние десятилетия определили использование у таких больных ГИБП, влияющих на сигнал-преобразующие молекулы и провос-палительные цитокины, отвечающие за воспаление и структурное повреждение [9, 10].
Голимумаб (ГЛМ) — полностью человеческое монокло-нальное антитело к фактору некроза опухоли (ФНО) а. Аффинность ГЛМ к растворимому ФНО, определенная in vitro, превышает таковую инфликсимаба (ИНФ) и адалимумаба (АДА) в 2,4 и 7,1 раза соответственно [11]. ГЛМ связывает и нейтрализует и растворимые, и мембранно-связанные формы ФНО [12]. Известно, что ФНО является провоспалитель-ным цитокином, определяющимся в высокой концентрации у больных РА, анкилозирующим спондилитом (АС) и псори-атическим артритом (ПсА). Он играет доминирующую роль в развитии различных воспалительных нарушений [13—16]. ФНО является и аутокринным стимулятором и потенциальным паракринным индуктором других провоспалительных
Основные критерии включения и исключения больных в РКПИ
Критерии включения Критерии исключения
РА по критериям ACR на протяжении >3 мес Гиперчувствительность к белкам человеческих IGg или другим компонентам ГЛМ
Лечение ингибиторами ФНОа ранее не проводилось Ранее проводилось лечение ингибиторами ФНОа, РТМ,
натализумабом, цитотоксическими препаратами, анакинрой или иными БПВП (кроме МТ)
МТ >15 мг/нед в течение >3мес: ГК в/в, в/м или в/с в течение 4 нед до первого введения исследуе-
2 из следующих критериев: исследуемого препарата
СРБ >1,5 мг/дл или СОЭ 28 мм при скрининге
утренняя скованность >30 мин
эрозии костной ткани, выявляемые рентгенологически
Удовлетворяют критериям скрининга на туберкулез Отсутствие тяжелых соматических заболеваний и активных
Примечание. В/в — внутривенное, в/м — внутримышечное, в/с — внутрисуставное введение; МРТ — магнитно-резонансная томография; ЧПС — число припухших суставов; ЧБС — число болезненных суставов.
Таблица 2. Характеристика больных, включенных в исследование GO-FORWARD
Характеристика ПЛ + МТ ГЛМ 100 мг ГЛМ + МТ
больных (n=133) + ПЛ (n=133) 50 мг (n=89) 100 мг (n=89) всего (n=178)
Средний возраст, годы 52 52 52 50 51
Ж. % 82,0 78,9 80,9 80,9 80,9
Средняя продолжительность РА, годы 6,5 5,9 4,5 6,7 5,3
РФ+, % 81,2 83,5 86,5 84,3 85,4
АЦЦП+, % 80,5 79,7 80,9 76,4 78,7
Среднее ЧБС 21 22 26 23 24,5
Среднее ЧПС 12 11 13 12 12,5
Активность РА ДОАБ28), средний балл 6,11 6,01 6,11 5,91 6,01
СРБ, мг/дл 0,8 0,9 1,0 0,9 0,95
цитокинов, включая семейство интерлейкинов [16]. ГЛМ относительно недавно, в 2012 г., был зарегистрирован в РФ для лечения взрослых больных РА, АС и ПсА, а в 2013 г. — для лечения язвенного колита. Препарат назначают подкожно по 50 мг 1 раз в месяц. В рандомизированных плацебоконт-ролируемых клинических исследованиях (РКПИ) оценивалась эффективность ГЛМ в дозе 50 и 100 мг подкожно ежемесячно в комбинации с МТ или в виде монотерапии.
Настоящее сообщение посвящено возможностям ГЛМ в лечении больных РА. Эффективность и безопасность ГЛМ в лечении РА доказана в различных когортах больных.
Эффективность ГЛМ у больных, не ответивших на терапию МТ
В исследовании II фазы у 172 больных РА с сохранением активности на фоне лечения МТ в дозе 10 мг/нед в течение 3 мес сравнивали эффективность ГЛМ в комбинации с МТ в двух дозах (50 и 100 мг) и в двух режимах введения (1 раз в 2 и 4 нед) с таковой в контрольной группе, получавшей МТ + плацебо (ПЛ) [17]. Через 16 нед оценивали первичную конечную точку — частоту достижения эффекта по критериям АСЯ20 [18]. Суммарно в группах получавших ГЛМ+МТ эффект был достигнут у 61,3% больных, а в группе, получав-
Пациенты с активным РА, несмотря на лечение МТ (n=444)
Воспаление суставов: причины артрита
Наиболее часто встречаемым хроническим воспалительным заболеванием является ревматоидный артрит, которым страдают около 70 млн. человек.
Ревматоидный артрит (РА) характеризуется болями в пораженных суставах и постепенным нарушением двигательной функции, что приводит к ухудшению качества жизни пациентов, наступлению стойкой утраты трудоспособности.
Как показывают статистические данные, почти половина заболевших ревматоидным артритом в течение 5 лет становятся инвалидами, а каждый десятый пациент получает инвалидность спустя 1,5 – 2 года от начала заболевания.
Протекание в организме хронического воспалительного процесса повышает вероятность возникновения и других патологий, которые называют сопутствующими (снижение иммунитета, остеопороз, атеросклероз и др.).
Помимо этого лечение РА нередко приводит к различным осложнениям со стороны желудочно-кишечного тракта, почек, свертывающей системы крови.

У 65% пациентов с РА болезнь медленно прогрессирует, течение заболевания характеризуется неполными ремиссиями и частыми обострениями.
У 25% больных РА имеет место злокачественное течение, при котором возникают множественные поражения суставного аппарата, нарушаются функции внутренних органов.
РА имеет сходный прогноз с лимфогранулематозом, инсулинозависимым сахарным диабетом. У пациентов с РА продолжительность жизни сокращается на 7 – 10 лет. Все это позволяет причислять РА к тяжелым хроническим заболеваниям.
В развитии РА играют роль множество факторов, что дает полное основание относить данную патологию к группе мультифакторальных болезней. В основе патологического механизма возникновения РА лежит обусловленное действием иммунной системы генерализированное воспаление (аутоиммунное воспаление).
Это воспаление затрагивает многие внутренние органы, но в большей степени синовиальные оболочки суставов . Воспалительный процесс приводит к разрастанию (гиперплазии) синовиальной ткани, разрушению гиалинового хряща и лежащего под ним субхондрального слоя кости.
Сегодня в патогенезе РА ученые отводят значительную роль действию фактора некроза опухоли - альфа (ФНО-α). Данный фактор представляет собой особый белок, название которого произошло от способности данного вещества вызывать геморрагический некроз (омертвение) опухолей.
Ранее считалось, что ФНО-α выполняет в организме человека только одну функции – защищает от возникновения опухолей . По мере изучения белка было обнаружено, что ФНО способен не только вызывать некроз клеток опухолей, но и выполнять другие биологические функции.
Однократное инъекционное введение препарата ФНО вызывало у подопытных животных повышение температуры тела, которое проходило с выраженным ознобом, диареей, снижением аппетита.
Если же ФНО-α вводился курсом, то у подобных животных развивалась кахексия (крайнее истощение организма).
В настоящее время установлено, что ФНО-α играет важную роль во многих физиологических и патологических процессах, протекающих в организме, в том числе в патологическом механизме развития РА. ФНО-α задействован в развитии воспаления, а также обладает иммуномодулирующим действием.
Как показали результаты исследований, ФНО-α:
- участвует в проявлении признаков воспаления (лихорадка, боль, потеря костной и мышечной массы);
- определяет миграцию белых клеток крови (лейкоцитов) в полость пораженного сустава за счет индуцирования экспрессии молекул адгезии; оказывает стимулирующее воздействие на синтез медиаторов воспаления (фактор активации тромбоцитов, простагландинов, желатиназы, коллагеназы, стромелизина), которые вызывают повреждения гиалинового хряща и кости;
- оказывает стимулирующее действие на рост новых кровеносных сосудов в зоне воспаления (неоангиогенез), а также способствует пролиферации (размножению) фибробластов, что приводит к разрастанию синовиальной оболочки и образованию ревматоидного паннуса (выросты синовиальной оболочки в подлежащие ткани – костную, хрящевую).
Неоднократные клинические исследования позволили установить, что в сыворотке крови, синовиальной жидкости и синовиальных тканях пациентов с РА отмечается повышенное содержание ФНО-α.
При этом уровень ФНО-α в сыворотке крови коррелирует (взаимосвязан) с активностью воспалительного процесса , определяемой по клиническим признакам.
Учитывая все сказанное выше, можно предположить, что основным медиатором воспаления при РА является ФНО-α и ему же принадлежит ведущая роль в патогенезе заболевания.
За последние десятилетия в терапии РА были достигнуты хорошие результаты. Сегодня в широкую клиническую практику внедрены ингибиторы ФНО-α – препараты, которые подавляют активность ФНО.
Ревматоидный артрит (РА) считается одним из самых тяжелых хронических заболеваний человека. Заболевание характеризуется выраженным воспалением с пролиферацией синовиальной оболочки суставов, поражением внутренних органов и систем, мног

Ревматоидный артрит (РА) считается одним из самых тяжелых хронических заболеваний человека. Заболевание характеризуется выраженным воспалением с пролиферацией синовиальной оболочки суставов, поражением внутренних органов и систем, многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей. До последнего времени в течение первых 5 лет болезни более 40% больных РА становились инвалидами [1]. Кроме того, многими авторами сообщается, что РА снижает продолжительность жизни больных в среднем на 10 лет [2, 3].
Течение РА весьма вариабельно. Это связано со многими причинами. Больной может оказаться резистентным к лечению, либо терапия оказывается не переносимой. Задержка с назначением терапии базисными противовоспалительными препаратами (БПВП) также ухудшает прогноз при РА. Кроме того, известно, что воспаление в синовиальной оболочке может начать развиваться задолго до появления первых клинических симптомов заболевания. Известно, что в крови больных РА за несколько лет до дебюта артрита (вплоть до 10 лет) выявляются серологические тесты, такие как ревматоидный фактор (РФ) и/или антитела к циклическому цитрулинированному пептиду (АЦЦП) [4] (рис. 1).
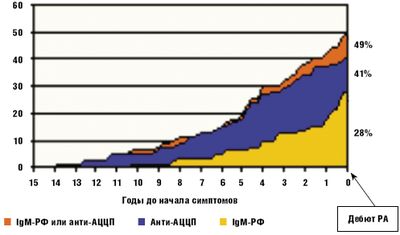
Морфологическое исследование синовиальной оболочки, полученной у больных в первые месяцы дебюта артрита, показало, что не у всех больных выявляются признаки острого ревматоидного воспаления, у части больных уже в первом биоптате отмечаются отчетливые признаки хронического синовита [5]. Именно у этих больных отмечался далее более торпидный вариант РА с плохим ответом на терапию БПВП. Тяжесть состояния больного РА на каждом этапе зависит от уровня воспалительной активности, что определяет выраженность болей в суставах, скованности, функциональных нарушений. При адекватно проводимой терапии и подавлении активности до развития необратимых анатомических изменений в суставах (деструкция, деформация) функция суставов восстанавливается (рис. 2). Тяжелый вариант течения болезни формируется при неадекватно проводимой или не эффективной терапии и определяется степенью стойкой утраты функциональной способности больного не только к профессиональному труду, но и к самообслуживанию. Поэтому как можно более раннее начало противовоспалительной терапии имеет при РА принципиальное значение.
В последнее десятилетие в практику ревматолога внедрены критерии раннего РА [6] для своевременного направления больного к ревматологу и раннего начала терапии. Идеальным должно считаться начало терапии БПВП сразу после появления первых симптомов воспаления в синовиальной оболочке: утренней скованности, боли в суставах и припухлости. На практике больной с дебютом РА проходит подчас длинный путь консультаций, диагностических мероприятий до встречи с ревматологом. Кроме того, начало болезни может быть клинически слабо выражено и симптомы болезни медленно нарастают, что затрудняет установление диагноза РА. По данным зарубежных авторов [7] и по нашим данным [8] при остром дебюте РА отдаленный исход болезни лучше, чем при постепенном начале заболевания. Вероятно, острое начало болезни заставляет пациента быстрее обращаться за врачебной помощью и позволяет врачу быстрее определиться с диагнозом и начать терапию. Наши данные свидетельствуют о лучшем исходе РА, оцененном через 15 лет болезни по степени сохранности функции опорно-двигательного аппарата, выраженности деструкции в суставах, частоте многолетних ремиссий и по выживаемости больных, при назначении БПВП в первые 6 месяцев от дебюта симптомов артрита [9]. Задержка с назначением БПВП приводит к более плохому ответу на эти препараты, что было показано в контролируемых исследованиях [10]. Препаратами первой линии считаются метотрексат и лефлуномид. Оба препарата способны подавлять активность и прогрессирование РА у большинства больных, особенно при назначении их в первые месяцы болезни. Но и начало терапии в очень ранний период болезни (1–2 месяца) не во всех случаях позволяет добиться выраженного эффекта (клинической ремиссии или поддержания субклинической активности РА). Во-первых, больной может не ответить на базисный препарат; во-вторых, у многих больных эффективность БПВП уменьшается через 1–2 года терапии, у части больных происходит последовательная смена базисных препаратов из-за симптомов непереносимости. При неэффективности и/или непереносимости последовательно назначаемых БПВП и формируется тяжелый вариант РА. Наиболее значимыми параметрами для определения тяжести РА являются выраженность деструктивных изменений в суставах и степень стойкой утраты функциональной способности суставов вплоть до утраты больным способности к самообслуживанию.
Большое количество рандомизированных клинических исследований (РКИ) было посвящено выявлению наиболее эффективных терапевтических стратегий в лечении больных РА: сравнивались результаты лечения при последовательной монотерапии БПВП, при их комбинации как в дебюте болезни (стратегия step-down), так и присоединение второго, третьего препаратов при неэффективности первого средства (стратегия step-up).
Оценка в сравнительном аспекте эффективности монотерапии метотрексатом, сульфасалазином, антималярийными препаратами, циклоспорином А, лефлуномидом и их комбинаций [11, 12, 13, 14, 15, 16, 17, 18] не показала однозначного преимущества комбинированной терапии БПВП перед их применением в виде монотерапии. В ряде исследований было показано, что через 6, 12 и 24 месяца клинический эффект был более выражен при использовании комбинации БПВП (либо при step-up, либо при step-down стратегии) [14, 16, 19, 20, 21, 22, 23], по данным других авторов [24, 25] не отмечено достоверных отличий во влиянии на показатели активности монотерапии или комбинации БПВП. При продлении срока исследований (до 5 лет) преимущества во влиянии на активность РА комбинации БПВП перед монотерапией не отмечено [11, 23, 24]. Оценка рентгенологических изменений в суставах через 1–2 года не показала преимуществ комбинированного лечения в исследовании MASCOT [16], а комбинация циклоспорина А и метотрексата в двух исследованиях через 6 [26] и 12 [27] месяцев в большей степени подавляла прогрессирование деструкции, чем монотерапия метотрексатом. В исследовании FIN-RACo изменение счета Ларсена было достоверно меньше при использовании комбинации БПВП через 2 года [14], но через 5 лет достоверных различий между комбинированной терапией и монотерапией уже не отмечалось [15].
Н. В. Чичасова, доктор медицинских наук, профессор Г. Р. Имаметдинова, кандидат медицинских наук Е. В. Иголкина С. А. Владимиров ММА им. И. М. Сеченова, Москва
Читайте также:


