Доктора наук об артрозе
Похожие темы научных работ по клинической медицине , автор научной работы — Дедух Н. В.
Кктково-м'язова система: вiд А до Я
Артроз — синонимы: остеоатроз, остеоартрит, деформирующий остеоартроз, гонартроз, дегенеративная артропатия и др. [1].
«Остеоартроз является одновременно результатом действия механических и биологических факторов, которые нарушают синхронные процессы биодеградации и образования клеток суставного хряща, а также субхондральной кости. Несмотря на то, что остеоартроз может быть инициирован многими факторами, включая генетические, ростовые (факторы развития), метаболические и травматические, заболевание поражает все ткани синовиальных суставов. В итоге остеоартрозные заболевания проявляются морфологическими, биохимическими, молекулярными и биомеханическими изменениями в клетках и матриксе, которые приводят к размягчению, фибрилляции, изъязвлению и уменьшению толщины суставного хряща, а также к остеосклерозу с резким утолщением и уплотнением кортикального слоя (эбурниации) субхондральной кости, формированию остеофитов и развитию суб-хондральных кист. Клинически остеоартроз про-
Последнее определение наиболее полно отражает также и патогенетические особенности остеоар-троза.
На сегодняшний день имеется Международная статистическая классификация болезней и проблем, связанных со здоровьем (Х пересмотр). В ней артроз находится в блоке М15-М19. Кроме того, в клинической практике используют различные классификационные критерии, основанные на систематизации клинических и рентгенологических признаков артроза: Американской коллегии ревматологов [5], классификации, построенной на оценке артроза различной локализации [6, 7] и др.
Артроз — наиболее распространенная форма суставной патологии: 10—12 % населения страдают этим заболеванием. Рентгенологические обследования, а также аутопсия показали, что начиная с 30-летнего возраста увеличивается количество дистрофических нарушений в суставах. В западных странах рентгенологические признаки артроза встречаются у большинства лиц старше 65 лет и практически у каждого человека после 75— 80 лет обнаруживаются признаки суставной патологии [8, 9].
Наиболее высокая частота артроза характерна для коленного, тазобедренного, локтевого суставов и суставов кистей. Заболеваемость остеоартрозом в Украине составляет 497,1, распространенность — 2200,6 на 100 тыс. населения [10, 11]. Наиболее высокая динамика показателей распространенности артрозов и заболеваемости в 2001 г. имела место в Ивано-Франковской области — 962,3 на 100 тыс.
населения, наименьший показатель зафиксирован для Ровенской области — 239,3 на 100 тыс. человек.
В США более 20 млн взрослого населения имеют клинические признаки артроза. Среди жителей США старше 30 лет симптоматический гонартроз встречается у 6 %, а коксартроз — приблизительно у 3 % населения. В Великобритании у населения возрастной группы старше 35 лет рентгенологические признаки артроза обнаруживаются у 70 % женщин и 69 % мужчин. У жителей Ямайки возрастной группы 35—64 года у 62 % женщин и 54 % мужчин имеют место признаки артроза.
Темнокожие жители Южной Африки также имеют высокий процент артрозов после 35 лет, у мужчин заболеваемость составляет 53 %, у женщин — 60 %. Коксартроз чаще обнаруживается у населения Кавказа, значительно меньше — среди жителей Китая или Африки. В популяции белокожих жителей Северной Америки и Северной Европы около 1/3 жителей в возрасте от 25 до 74 лет имеют рентгенологические признаки остеортроза, поражающего кисти рук, суставы стопы, коленный и тазобедренный.
Традиционно считают, что холодный и влажный климат усиливает проявление клинических симптомов заболевания. Однако у жителей Аляски процент остеоартроза намного ниже, чем в других популяциях: после 40 лет 24 % женщин болеют остеоартрозом и 22 % — мужчин [12].
Для каждого сустава скелета характерна определенная кинетика развития патологического процесса. При увеличении возраста к наиболее поражаемым суставам могут быть отнесены коленный и локтевой, в меньшей мере — плечевой. Промежуточное положение между ними занимают тазобедренные суставы, частота патологии в которых к 80—95 годам достигает 60 %.
Анализ распространенности артроза свидетельствует о неодинаковой частоте его возникновения в различных странах мира, а также о наличии преимущественного поражения тех или иных суставов.
Имеют место половые различия в проявлении патологии. До 50-летнего возраста у мужчин выше распространенность артроза по сравнению с женщинами, однако после 50 лет у женщин чаще наблюдается артроз коленных суставов, кисти и стопы.
Артроз у лиц молодого возраста чаще всего является последствием перенесенных травм, воспалительных процессов, врожденных заболеваний опорно-двигательного аппарата, дифференцированной и недифференцированной дисплазии соединительной ткани.
Факторы, ассоциируемые с остеоартрозом
I. Генетические факторы
2. Наследственные нарушения коллагена II типа (например, синдром Стиклера)
3. Мутации гена коллагена II, IX и X типов, фактора роста и пролиферации (FGD-5)
4. Другие наследственные заболевания костей и суставов
5. Нарушения развития сустава (дисплазии)
II. Негенетические (ненаследуемые) множественные факторы
2. Избыточный вес
3. Нарушение эндокринного баланса организма, в т.ч. снижение секреции эстрогенов (т.е. период постменопаузы)
4. Метаболические нарушения в организме
5. Состояние эндокринной системы
6. Анатомические деформации
7. Дефицит (или избыток?) в организме микроэлементов
8. Следствие проявления патологического процесса в пояснично-крестцовом отделе позвоночника (hip-spine syndrome), плечелопаточный периартрит
9. Воспалительный процесс в суставе
11. Инфекционно-аллергические факторы
13. Факторы окружающей среды:
— нарушение экологического равновесия, действие химических токсикогенов;
— травма сустава, неоднократные микротравмы;
— предыдущие операции на суставах (например, менискэктомия);
— род занятий и физическая активность на работе;
Патоморфологическая картина артроза
Различают две основные формы остеоартро-за: первичный, или идиопатический, остеоартроз, этиология которого неизвестна, и вторичный, возникновение которого обусловлено нарушениями в суставе, вызванными воздействием факторов, перечисленных выше. Четких границ в проявлении дегенерации между первичным и вторичным артрозом не существует.
Основу повреждения при остеоартрозе составляют нарушения суставного хряща, проявляющиеся снижением клеточного состава, апоптозом клеток, нарушением организации матрикса как колла-геновой структуры, так и основного вещества, что сопровождается истончением суставного покрытия и его потерей на участках [13]. При артрозе меняется фенотип хондроцитов, в результате чего вместо фибриллярного коллагена II типа они синтезируют преимущественно нетипичный для суставного хряща нефибриллярный коллаген III типа и аггрекан с нарушенной структурой за счет деполимеризации макромолекул, сопровождающейся образованием мономеров и белково-полисахаридных молекул с низкой молекулярной массой. Синтезированные протеогликаны слабо связываются с гиалуроновой
Таблица 1. Степень поражения суставного хряща при артрозе [14]
Степень 0 Здоровый хрящ
Степень 1 Поверхностная зона интактна, присутствует отек и/или разволокнение матрикса, пролиферация и гипертрофия хондроцитов
Степень 2 Степень 1 + нарушение целостности поверхностной зоны, снижение окраски матрикса в 1/3 (верхний отдел) промежуточной зоны, нарушение ориентации колонн хондроцитов в глубокой зоне
Степень 3 Степень 2 + снижение окраски матрикса в 2/3 области глубокой зоны + новообразование коллагеновых волокон, формирование вертикальных трещин
Степень 4 Отслоение поверхностной зоны, нарушение матрикса суставного хряща с формированием кист и эрозий
Степень 5 Обнажение подлежащей кости
Степень 6 Неравномерность суставного покрытия на участках за счет обнажения подлежащей кости, ремоделирование кости, формирование остеофитов, микропереломы, нарушение регенерации
кислотой, а формирующиеся комплексы — с кол-лагеновой сетью хряща, что способствует их нестабильности, и они легко вымываются из матрикса. Структурные нарушения в комплексе с метаболическими и биомеханическими приводят к формированию остеофитов. Как результат нарушений, в патологический процесс вовлекается весь сустав, в том числе и мягкотканные структуры. Развивается синовит, прогрессирует слабость мышц и связок.
Процесс регенерации суставного хряща при артрозе носит аномальный характер и заключается в формировании изогенных групп клеток (до 10 хон-дроцитов), редко располагающихся на территории матрикса с нарушенной организацией.
На основе анализа гистологических изменений суставного хряща Международным обществом по изучению остеоартроза (OARSI) предложена новая классификация, позволяющая выделить 6 степеней и 4 стадии поражения суставного хряща (табл. 1, 2).
Механизмы развития остеоартроза
Отдельные патогенетические звенья артроза представлены ниже.
Избыточные нагрузки на суставы_
Значительную роль в патогенезе артроза играет несоответствие между механической нагрузкой на суставную поверхность хряща и адаптационно-компенсаторными возможностями хрящевой ткани. Поэтому артроз часто развивается у лиц, выполняющих тяжелую физическую работу, сопряженную с перегрузками суставов, у спортсменов, например у теннисистов (локтевой сустав), кузнецов (плечевой сустав), маляров (лучезапястный сустав) и др. Хронической микротравматизации суставного хряща способствуют дисплазии и гипермобильность суставов. В целом риск развития ар-
Таблица 2. Стадии поражения суставного хряща в зависимости от объема (%) дегенерации
Стадия 0 Нет признаков артроза
троза у лиц с врожденными дефектами опорно-двигательной системы значительно повышен.
Важное значение в развитии артроза имеют травматические повреждения — внутрисуставные переломы, вывихи, разрывы связок и сухожилий, перенесенные операции на суставах или переломы костей, прилежащих к суставу.
Неадекватные механические нагрузки приводят к разрушению клеток и нарушению фенотипа хон-дроцитов, что сопровождается повышением биосинтеза провоспалительных цитокинов, протеоли-тических ферментов и снижением биосинтеза хон-дроцитами основных макромолекул матрикса — коллагена и протеогликанов.
Провоспалительные цитокины и ферменты в разрушении суставного хряща_
К дегенерации суставного хряща приводит повышенный биосинтез провоспалительных цитокинов. Клетками синовиальной мембраны, в основном си-новиоцитами макрофагального типа, продуцируются провоспалительные цитокины, которые, поступая в синовиальную жидкость, влияют на функционирование хондроцитов суставного хряща, стимулируя биосинтез интерлейкина-1 (ИЛ-1), -3, -4, фактора некроза опухоли альфа, оксида азота и матриксных металлопротеаз. Синовиоциты выступают как главный источник биосинтеза катаболи-ческих ферментов, вовлеченных в процесс остеоартроза: коллагеназ-1, -2 и -3, стромелизина-1 и же-латиназы 92 кД. Оксид азота в высоких концентрациях нарушает биосинтез макромолекул матрикса суставного хряща и вызывает апоптоз хондроцитов. Разрушение аггрекана — основного протеогликана суставного хряща — осуществляется аггреканазой, обладающей свойствами металлопротеаз.
Существуют естественные ингибиторы цитоки-нов, которые способствуют связыванию цитокинов с рецепторами клеточных мембран (ИЛ-1РА, ИЛ-1 РА, ИЛ-1 бета, рр55 и рр75 и др.) [11]. По всей вероятности, при артрозе существует дисбаланс провоспалительных и воспалительных цито-кинов.
Фактор гипоксии и артроз_
В развитии артроза принимают участие многие факторы, среди которых ведущее место зани-
мает гипоксия и ишемия. Определен транскрипционный фактор, индуцирующий гипоксию (Н№-2 альфа), играющий важную роль в регуляции чувствительности клеток к метаболическому и оксида-тивному стрессу [15, 16]. Повышение уровня Н№-2 альфа негативно отражается на состоянии суставного хряща, так как этот белок стимулирует функционирование протеаз, осуществляющих катабо-лические процессы в суставном хряще. Этот фактор является регулятором процессов энхондраль-ной оссификации, индуцируя NF-кB сигнальный путь, контролируя прогрессирование артроза и развитие остеофитов. Авторы считают, что в будущем он может быть рассмотрен как терапевтическая мишень остеоартроза, поскольку низкий уровень Н№-2 альфа способствует защите хряща от дегенерации и формирования остеофитов.
Иммунные нарушения и артроз_
Проблема аутоиммунных процессов в патогенезе остеоартроза активно изучается. Разрушение матрикса суставного хряща, в частности коллагена и протеогликанов, фрагментов, попадающих в полость сустава, сопровождается их фагоцитозом лейкоцитами, что влечет за собой высвобождение медиаторов воспаления, лизосомальных ферментов. Клинически это проявляется явлениями синовита и развитием иммунных реакций клеточного и гуморального иммунитета на продукты распада. Сенсибилизация продуктов распада Т- и В-лимфоцитов проявляется повышенной выработкой лимфокинов, образованием иммунных комплексов, антител к хрящевой ткани и синовиальной мембране. Это приводит к фибротизации синовиальной мембраны, нарушает выработку синовиальной жидкости, что отражается на питании и лубрикации суставного хряща. Развивающийся иммунопатологический процесс в суставном хряще и синовиальной оболочке замыкает дегенерацию хряща. Одним из звеньев аутоиммунных нарушений в патогенезе может быть белок фибулин, выделенный из синовиальной жидкости, к которому у 23,9 % больных остеоартрозом обнаружены антитела [17].
Ожирение и артроз_
Выявлены особенности механизмов развития артроза у пациентов с ожирением. Повышение индекса массы тела более 25—27 усл.ед. увеличивает риск развития артроза на 15 % [8]. При этом как основу факторов риска развития дегенерации суставного хряща рассматривают продукты биосинтеза клетками жировой ткани провоспалительных медиаторов и адипокинов, в частности лептина [18]. Повышенное содержание интерлейкина-6 и лептина выявлено у людей пожилого возраста при коксартрозе. Агрессивной клеткой выступает макрофаг, секретирующий провоспалительные ци-токины — интерлейкин-6 и фактор некроза опухолей альфа. При этом характер распределения под-
кожной жировой клетчатки (центральный или периферический) не влияет на вероятность развития гонартроза.
Субхондральная кость и остеоартроз_
С одной стороны, увеличение микротрещин в суставном хряще вследствие повышенной механической нагрузки, формирование участков без покрытия приводит к увеличению жесткости субхон-дральной кости. Это проявляется снижением амортизирующих свойств суставного хряща и, в свою очередь, инициирует и поддерживает в нем дегенеративные проявления. Кроме того, в субхондральной кости при остеоартрозе зафиксировано увеличение скорости ремоделирования, как повышение резорбции, так и костеобразования, что проявляется склерозированием и формированием кист в этой области. Было выявлено, что у больных коксартро-зом в остеоцитах и остеобластах субхондральной костной ткани повышен уровень биосинтеза метал-лопротеаз и щелочной фосфатазы, нарушается биосинтез коллагена. В экспериментах in vitro доказано, что клетки костной ткани, полученные от пациентов с артрозом, влияют на биосинтез гликозами-ногликанов в суставном хряще. Возможно, побудительным механизмом является повышенная секреция остеокальцина и провоспалительных цитоки-нов, способных модифицировать хрящевой метаболизм.
С другой стороны, эти нарушения в субхондраль-ной кости исследователи рассматривают как первичное звено, способствующее инициации остео-артроза. Доказательства этого были получены в эксперименте на животных [19].
Нарушение эндокринного баланса организма
В настоящее время доказано, что гормональные влияния являются существенными регуляторами на этапах роста и развития хрящей, а хондроциты имеют специфические рецепторы к ряду гормонов: тироксину, инсулину, глюкокортикоидам, сома-тотропину, эстрадиолу, андрогенам и пролактину. Нарушение эндокринного баланса организма рассматривается как фактор риска, приводящий к изменению равновесия между анаболическими и ка-таболическими процессами в суставном хряще и, как следствие, — развитию дегенерации [12]. Однако многие аспекты и механизмы воздействия гормонов на суставной хрящ до настоящего времени не раскрыты.
Таким образом, изучение доли вклада факторов риска в патогенез такой сложной и распространенной патологии, как артроз, расширяет представления об этом заболевании и позволяет разработать специфические мероприятия подходов к диагностике и лечению.
1. Cervini C. J'artrosi terminología // R. Margolongo, J'artrosi. — Milan: Realizzazioni scientifiche, 1996. — P. 15-19.
2. Артрозы. Большая медицинская энциклопедия. — М., 1975. — Т. 2. — 679 с.
3. Энциклопедический словарь медицинских терминов: В 3 томах / Гл. ред. Б.В. Петровский. — М.: Советская энциклопедия, 1982. — Т. 1. — С. 94.
4. Creamer P., Goldberg M.C. Osteoarthritis // The Lancet. — 1997. — Vol. 350. — Р. 503-509.
5. Altman R., Alarcon G., Appelrouth D. et al. The American College of Rheumatology criteria for classification and reporting of osteoarthritis of the hip // Arthritis Rheum. — 1991. — Vol. 34. — P. 505-514.
6. Altman R., Alarcon G., Appelrouth D. et al. The American College Rheumatology criteria for the classification and reporting of osteoarthritis of the hand // Arthritis Rheum. — 1990. — Vol. 33. — P. 1601-1610.
7. Altman R., Asch E., Blochj D. et al. Development of criteria for classification and reporting of osteoarthritis. Classification of osteoarthritis of the knee. Diagnostic and therapeutic criteria committee of the American rheumatism association // Arthitis Rheum. — 1986. — Vol. 29. — P. 1039-11049.
8. Остеоартроз: консервативная терапия. Монография / Авт. кол.: Н.А. Корж, А.Н. Хвисюк, Н.В. Дедух и др. Под ред. Н.А. Коржа, Н.В. Дедух, И.А. Зупанца. — Харьков: Золотые страницы, 2007. — С. 14-47.
9. Поворознюк В.В. Остеоартроз: современные принципы лечения // Новости медицины и фармации. — 2004. — Т. 144, № 4. — С. 10-11.
10. Коваленко В.М., Корнацький В.М., Шуба Н.М. та in. Ревматичш хвороби в Украшк сучасний стан проблеми i надання медично! допомоги та шляхи покращання. — К., 2004. — С. 23-26.
11. Коваленко В.Н., Борткевич О.П. Остеоартроз. — К.: Морюн, 2003. — 448 с.
12. Peyron J.C., Altman R.D. Osteoarthritis: diagnosis and medical surgical management. — 2nd ed. — Philadelfia, Pa: WB Sauders Company, 1992. — P. 15-37.
13. Pritzker K.P.H.S., Gay S.A. Osteoarthritis cartilage histo-pathology: grading and staging // Osteoarthritis and cartilage. — 2006. — Vol. 14. — P. 13-29.
14. Saito T., Kawaguchi H. HIF-2a as a possible therapeutic target of osteoarthritis // Osteoarthritis Cartilage. — 2011. — Vol. 8, № 12. — Р. 1552-1556.
15. Saito T, Kawaguchi H. Transcriptional regulation of osteoarthritis // Clin. Calcium. — 2011. — Vol. 21, № 6. -Р. 853-859.
16. Xiang Y., Sekine T., Nakamura H. et al. Fibulin-4 is a tar-getof autoimmunity predominantli in patients with osteoarthri-tis // J. Immunol. — 2006. — Vol. 176. — Р. 3196-3204.
17. Richette P., Funk-Brentano T. What is New on Osteoarthritis Front // Eur. Musculoskeletal Rev. — 2010. — Vol. 5, № 2. — Р. 8-10.
Артрозу коленного сустава (гонартрозу) принадлежит ведущее место в группе артрозных поражений суставов конечностей. Пациенты с артрозом коленного сустава постоянно преобладают среди больных, посещающих поликлиники, но, к сожалению, их мало среди тех, кто лечится в наших стационарах. лечение в стационарных условиях могло бы дать куда больший эффект, нежели амбулаторная терапия "без отрыва от производства". Известное врачам более 100 лет это заболевание в быту носит название "отложение солей".
В действительности при артрозе могут встречаться обызвествления (отложения солей кальция) в мягких тканях колена - связочном аппарате, местах прикрепления сухожилий и т.п., но эти обызвествления носят ограниченный характер и не имеют, как правило, самостоятельного клинического значения. На первый план при гонартрозе выступает дегенеративно-дистрофический процесс в гиалиновом хряще, покрывающем мыщелки бедренной и большеберцовой костей. А начинается патологический процесс с нарушения кровообращения в мелких костных сосудах, вслед за которыми происходят изменения в хрящевом покрове сустава.
Начальные изменения развиваются на молекулярном уровне в хрящевой ткани, а итогом их постепенно становятся заметные изменения гиалинового хряща: он местами мутнеет, истончается, расслаивается и даёт трещины в разных направлениях. Наконец, патологический процесс может завершиться полным исчезновением хряща на большем или меньшем протяжении, обнажением подлежащей кости. Последняя реагирует на гибель хрящевого покрытия уплотнением (склерозом) субхондральной зоны, избыточным разрастанием кости по периферии (так называемые "шипы"), деформацией и осевым искривлением ноги; отсюда идёт полное название заболевания - деформирующий артроз. Условно артроз коленного сустава можно разделить на первичный и вторичный.
Первичный артроз коленного сустава развивается на обычном жизненном фоне. Страдают люди пожилого возраста, женщины чаще, чем мужчины. К развитию артроза коленного сустава явно расположены люди с повышенной массой тела, ожирением. Вторичный артроз коленного сустава имеет в своей основе травму коленного сустава (внутрисуставной перелом бедра и большеберцовой кости, разрыв связок, повреждение менисков, гемартороз) или перенесённое заболевание (артрит различной этиологии, хондроматоз суставов, "суставная мышь" и др.). Своевременное адекватное лечение перечисленных процессов может препятствовать возникновению и развитию гонартроза. Жалобы больного с артрозом коленного сустава вначале сводятся к ощущению определённой скованности в суставе, "стягиванию" под коленом, болям в нём после длительной ходьбы.
Большинство пациентов жалуется также на затруднения при ходьбе по утрам, после сна или после более или менее длительного сидения. "Расходишься, - становится легче", - отмечают они. С течением времени заболевание прогрессирует, боли становятся упорными, постоянными, интенсивными; боль чаще локализуется на внутренней стороне колена. Многие больные ощущают хруст при движениях в коленном суставе. Постепенно развивается ограничение сгибания и (или) разгибания. С течением времени прогрессирует хромота. В тяжёлых случаях больные вообще не могут передвигаться без посторонней помощи или без опоры на спинку стула, костыли и т.п. В лежачем положении боль утихает, но иногда больные страдают от болей и по ночам.
Осмотр коленного сустава в начальной стадии заболевания не обнаруживает внешних изменений. В дальнейшем можно отметить деформацию колена, грубые контуры костей, образующих сустав, контрактуру (неполное разгибание или сгибание) и искривление оси голени, как правило, кнутри. Если положить ладонь на переднюю поверхность колена, то при сгибательно-разгибательных движениях исследующий ощутит хруст в коленном суставе различной интенсивности и продолжительности. Такое же ощущение хруста можно получить, сдвигая надколенник кнаружи и кнутри в поперечном направлении (положительный пателло-кондилярный симптом).
При пальпации сустава выявляется болезненная зона, чаще с внутренней стороны сустава, на уровне мыщелков бедра, большого берца и суставной щели. Нередко в полости коленного сустава накапливается выпот, т.е. присоединяется синовит. Это состояние определяется сглаженностью контуров коленного сустава за счёт выбухания, выпячивания тканей над надколенником и сбоку от него и ощущением флуктуации при ощупывании выпячивания двумя руками.
Синовит коленного сустава свидетельствует об осложнении артроза асептическим воспалительным процессом, и тогда мы имеем основание обозначать такое состояние коленного сустава как "артрозо-артрит". Температура при артрозо-артрите, как правило, не повышается и анализы крови не показывают отклонений от нормы.
Субъективно больные определяют присоединившийся синовит как новое ощущение тяжести в суставе, мешающее сгибанию колена. Как видно из приведённых данных, клиническая диагностика гонартроза несложна, вполне доступна. Однако в любом случае необходимо рентгенологическое исследование. Оно подтверждает и уточняет диагноз, устанавливает степень артрозных изменений, позволяет следить за динамикой процесса на протяжении времени и, наконец, рентгенография необходима для исключения опухолевого или какого-нибудь иного процесса в костях, образующих сустав. В начальной стадии гонартроза рентгенологические изменения могут либо отсутствовать, либо быть весьма незначительными. В более поздние сроки выявляется сужение суставной щели, склероз подхрящевой зоны, заострение краёв мыщелков бедренной и большеберцовой костей, иногда отложение солей в окружающих мягких тканях. Рентгенологическое обследование пожилых и старых людей у многих из них выявляет выраженные изменения, описанные выше.
Но далеко не все обследованные имеют симптомы гонартроза. Отсюда можно сделать вывод, что между артрозом и возрастными изменениями суставов нельзя ставить знака равенства. Лишь сочетание клинических и рентгенологических признаков должно определять понятие "артроз коленного сустава". Лечение артроза коленного сустава представляет трудную задачу. Оно может быть консервативным и оперативным. Основой консервативного лечения являются покой и разгрузка поражённого коленного сустава. При невыполнении этого условия любое консервативное лечение окажется малоэффективным. В стационарных условиях используют манжеточное вытяжение за голень для полноценной разгрузки коленного сустава.
В комплексе лечения артроза коленного сустава положительную роль играет лечебная гимнастика. Она проводится больным с целью профилактики контрактур, улучшения кровообращения в конечности, повышения мышечного тонуса. Очень важно провести первый урок гимнастики утром, прежде чем встать на ноги и начать ходить. Комплекс упражнений следует получить в кабинете лечебной физкультуры и выполнять его 3-4 раза в день; особенно это важно при переходе из горизонтального положения в вертикальное. После работы рекомендуется отдых лёжа 30-45 минут. Полуспиртовые согревающие компрессы и тёплые (36-36оС) ванны (можно с хвоей) перед сном завершают домашнее лечение. Проведение его целиком зависит от пациента, и нужно убедить его в важности пунктуального выполнения рекомендаций.
Лечение гонартроза дополняют различные виды физиотерапии (диадинамические токи, фонофорез с гидрокортизоном, электрофорез с новокаином, ультрафиолетовое облучение, УВЧ), лазеро-, магнитотерапия, массаж ноги. Полезно санаторное лечение, которое можно проводить на любом курорте, если в перечне показаний к лечению имеется ссылка на "заболевания органов движения".
Увлечение внутрисуставным введением гидрокортизона и других стероидных гормонов уступило место взвешенному подходу к лечению. С гормональной терапией конкурирует, а в ряде случаев и дополняет её метод внутрисуставной оксигенотерапии. Он заключается во введении в полость коленного сустава газообразного медицинского кислорода. Правильное лечение внутрисуставных переломов, удаление повреждённых менисков, восстановление разорванных связок, удаление "суставной мыши" являются одновременно профилактикой гонартроза. Однако и при развивающемся артрозе на почве этих процессов оперативное лечение может приостановить развитие артроза и существенно облегчить состояние больного.
Медикаментозному лечению гонартроза, несмотря на повсеместное применение, принадлежит весьма скромная роль. Решение проблемы артроза коленного сустава в определённой степени зависит от его профилактики. Разумное сочетание труда и отдыха, занятия физкультурой, позволяющие долгие годы сохранять тонус сосудистой и мышечной систем, недопущение увеличения массы тела, своевременное обращение за квалифицированной помощью - вот основные факторы профилактики деформирующего артроза коленного сустава.
Актуальность проблемы. Жизнь человека – это непрерывное движение. Но именно движение представляет для суставов наибольшую опасность, которая заключается в возможности возникновения травм и перегрузок, исходом которых является развитие одного из тяжелых заболеваний опорно-двигательного аппарата – артроза [1,4,6,9].
Травмы – одна из частых причин развития артроза. Даже незначительное повреждение может вызывать нарушение трофики и иннервации сустава, что провоцирует дегенеративные процессы и развитие артроза [6,9].
По данным статистики, наибольшему травматизму подвержены мужчины в возрасте 20–50 лет, женщины в возрасте 30–60 лет. Травмы возникают в быту, на производстве, на улице, в результате дорожно-транспортного происшествия и т.д. Особенно актуальна это проблема для спортсменов и людей, ведущих активный образ жизни [1,6,8].
В структуре травм ведущее место занимают травмы коленного и тазобедренного сустава, реже встречаются травмы голеностопного, локтевого и плечевого суставов.
Наиболее частыми и тяжелыми осложнениями таких травм являются развитие деформирующего артроза и стойких контрактур коленного сустава по причине, в большинстве случаев, неустраненных смещений отломков мыщелков большеберцовой кости. Немаловажное значение имеет тяжесть самой травмы – значительные разрушения опорной суставной поверхности большеберцовой кости могут также стать причиной развития деформирующего артроза коленного сустава [8,9].
Патогенез посттравматического и других вторичных артрозов на конечных стадиях развития схож. Хрящ теряет свою упругость, эластичность, становится шероховатым, в нем появляются трещины с обнажением кости. Отсутствие амортизации при давлении на суставные поверхности костей приводит к их уплотнению (субхондральный остеосклероз) с образованием участков ишемии, склероза, кист. Одновременно с этим, по краям суставных поверхностей эпифизов костей суставной хрящ компенсаторно разрастается с последующим окостенением, с образованием краевых остеофитов и деформацией суставных поверхностей.
Лечение посттравматического артроза – сложный и длительный процесс. Существующие на сегодняшний день способы лечения посттравматического артроза (ПТА) направлены на реализацию одной цели – остановить, или замедлить дегенеративные процессы, происходящие в поврежденном суставе, и включают как консервативные, так и хирургические методы (показаны при тяжелой степени заболевания) [1,5,6,10].
Консервативные методы (медикаментозные: прием НПВС, ангиопротекторов, в/суставное введение ингибиторов протеолиза, препаратов гиалуроновой кислоты и хондропротекторов; немедикаментозные: разгрузка и покой сустава, ЛФК, массаж, физиотерапевтические методы, иглорефлексотерапия, оксигенобаротерапия, бальнеологическое лечение) – наиболее распространенны и направлены на купирование боли, устранение мышечной и артрогенной контрактуры, улучшение функции сустава, коррекцию внутрисуставных нарушений, стимуляцию метаболизма в организме в целом [1, 6-9].
Необходимо отметить, что существующие методы консервативного лечения, посттравматических артрозов, особенно внутрисуставные инъекции хондропротекторов, имеют ряд недостатков, к которым относятся аллергические реакции и дороговизна препаратов, длительный курс лечения, что вызывает дополнительную травму и инфицирование, и, к сожалению, нестойкий результат – около 3-х месяцев.
Пристальный интерес к аутоплазме связан с содержанием в тромбоцитах многочисленных факторов роста и цитокинов, которые способствуют регенерации поврежденных тканей. Свыше 30 ростовых факторов выявлено в α-гранулах тромбоцитов. Они влияют на процессы восстановления всех тканей сустава одновременно. Наибольшее значение имеют: тромбоцитарный фактор роста (PDGF) – стимулирует хемотаксис, митогенез фибробластов, синтез коллагена; фактор роста эндотелия сосудов (PDEGF) – оказывает стимулирующее действие на эндотелиальные клетки; трансформирующий фактор роста (TGF-ß) последний представляет собой большую группу белков, некоторые из них и морфогенные белки модулируют клеточную пролиферацию и дифференцировку малодифференцированных клеток в остеобласты, увеличивают синтез внеклеточного матрикса кости и ингибируют его деградацию и др. факторы роста [2-5;10].
Материалы и методы исследования
Материалы исследования составили 35 пациентов в возрасте 35–70 лет с тяжелыми деформирующими артрозами коленного сустава различной этиологии. Все пациенты ранее проходили курсы консервативной реабилитационной терапии. У подавляющего большинства пациентов сколько-нибудь значительного улучшения не отмечено. При этом относительное большинство пациентов были с посттравматическими деформирующими артрозами. Из всех пациентов больных с посттравматическими артрозами коленного сустава было 24, у 11 пациентов имели место идиопатические артрозы коленного и тазобедренного суставов на фоне остеохондроза поясничного отдела позвоночника. Всем пациентам применено внутрисуставное введение тромбоцитарной аутоплазмы.
Лечение пациентов с применением инъекционной тромбоцитарной аутоплазмы
Рис.1. Пробирка Plasmolifting™ (содержит антикоагулянт)

Результаты исследования показали, что применение инъекционной тромбоцитарной аутоплазмы значительно улучшают качество жизни пациентов с деформирующими артрозами, что подтверждалось как субъективной оценкой самих обследуемых, которые отмечали значительное снижение болевого синдрома, восстановление функции сустава, уменьшение и даже полное отсутствие скованности сустава, так и достоверной динамикой показателей шкалы Womac (рис. 3).
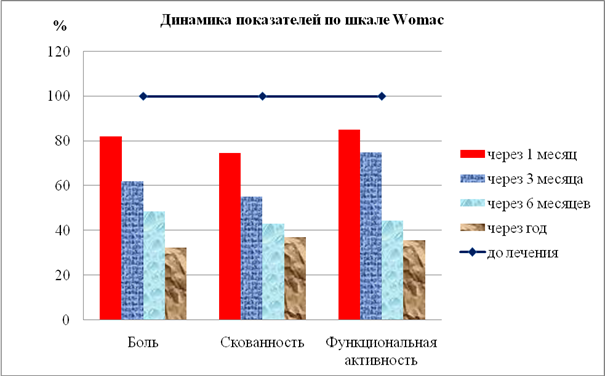
Рис. 3. Показатели шкалы Womac в динамике лечения с применением инъекционной тромбоцитарной аутоплазмы (показатели до лечения учитывались как 100 %)
Данные биомеханического исследования опорной, динамической функции нижних конечностей, сенсорного баланса в вертикальной стойке подтвердили клинические данные функциональной реабилитации.
Клинический пример. Пациент Л., 1959 г.р. обратился с жалобами на сильные боли, ограничение функции обоих в коленных суставах. Болен в течение 10 лет, консервативная терапия неэффективна. На основании клинико-рентгенологических данных установлен диагноз: двусторонний деформирующий артроз III стадии. Проведен курс плазмотерапии, который составлял по три внутрисуставных блокады с интервалом 1 неделя. После второй блокады отмечено значительное улучшение, уменьшение интенсивности болей, улучшение функции суставов. Контрольные исследования на сроках 2 месяца и год после лечения также показали значительное улучшение функции коленных суставов и нижних конечностей.
Таким образом, применение инъекционной тромбоцитарной аутоплазмы в комплексной терапии посттравматических артрозов крупных суставов способствует восстановлению функции сустава, уменьшению дегенеративных явлений, что сопровождается увеличением объема движений в суставе, улучшением опорно-двигательной функции нижних конечностей, а также удлинением периода ремиссии заболевания.
Читайте также:


