Доброкачественные опухоли костей клинические рекомендации
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2020
Профессиональные ассоциации
- Общероссийский национальный союз "Ассоциация онкологов России"
- Автономная некоммерческая организация "Восточно-Европейская группа по изучению сарком"
- Общероссийская общественная организация "Российское общество клинической онкологии"
Одобрено Научно-практическим Советом Минздрава РФ
Оглавление
1. Краткая информация
- опухоль неэпителиального происхождения;
- развивается из клеток производных мезодермы.
- лучевая терапия,
- иммунодефицит,
- болезнь Педжета,
- болезнь Олье,
- доброкачественные опухоли кости.
У большинства пациентов этиологические факторы не выявляются.
Первичные ЗНО костей 0,001 % от всех впервые выявленных ЗНО.
В РФ заболеваемость 1,03 случая на 100 тыс. населения, как в других странах.
Злокачественное новообразование костей и суставных хрящей (C40):
C40.0 – лопатки и длинных костей верхней конечности;
C40.1 – коротких костей верхней конечности;
C40.2 – длинных костей нижней конечности;
C40.3 – коротких костей нижней конечности;
C40.8 – поражение костей и суставных хрящей конечностей, выходящее за пределы одной и более вышеуказанных локализаций;
C40.9 – костей и суставных хрящей конечности неуточненной локализации.
Злокачественное новообразование костей и суставных хрящей других и неуточненных локализаций (C41):
C41.0 – костей черепа и лица;
C41.1 – нижней челюсти;
C41.2 – позвоночного столба;
C41.3 – ребер, грудины и ключицы;
C41.4 – костей таза, крестца и копчика;
C41.8 – поражение костей и суставных хрящей, выходящее за пределы одной и более вышеуказанных локализаций;
C41.9 – костей и суставных хрящей неуточненное.
Стадирование
По TNM AJCC/UICC 7-го пересмотра (2010 г.) (TNM AJCC/UICC 8-го пересмотра (2019 г.)
Клиника определенной стадийности и зависит от локализации опухоли.
Первый симптом - боль.
Возможна субфебрильная температура.
Быстрая прогрессия - через 2–3 месяца припухлость и гиперемия кожи.
Нарушение функции при локализации вблизи сустава.
Без лечения через 5–7 месяцев - выраженная прогрессирующая интоксикация:
- слабость,
- резкое похудание,
- повышение температуры тела,
- лейкоцитоз,
- увеличенная СОЭ.
2. Диагностика
- доброкачественные опухоли,
- метастатические опухоли костей,
- остеомиелит,
- артрит,
- дегенеративно-дистрофические изменения суставов.
Критерии установления диагноза:
- анализ жалоб пациента,
- осмотр,
- данные инструментальных и лабораторных исследований,
- морфологическая верификация.
Сбор анамнеза, в том числе наследственного и онкологического.
У пациентов старше 40 лет необходимо исключить метастатическое поражение костей.
- начало развития заболевания,
- наличие болевого синдрома,
- изменения функции.
Оценить влияние клиники на качество жизни пациента.
- Оценить состояние области пораженной кости.
- Проверить функцию сустава.
- Исключить риск патологического перелома.
- Пальпация периферических лимфоузлов.
- общий̆ (клинический) мочи,
- общий̆ (клинический) крови,
- общетерапевтический биохимический крови,
- коагулограмма.
Рентгенография пораженной области и близлежащего сустава в двух проекциях с линейкой.
МРТ пораженного отдела скелета.
КТ органов грудной клетки.
При подозрении на диссеминацию:
- сцинтиграфия с 99Tc,
- УЗИ брюшной полости, забрюшинного пространства, периферических лимфоузлов.
При саркоме Юинга - биопсия костного мозга с миелограммой.
Для верификации - биопсия опухоли.
Стандарты биопсии опухоли:
1. Под контролем сертифицированного онкоортопеда или радиолога.
2. Морфологическая верификация проводится в крупных онкологических ЛПУ.
3. Предпочтительна толстоигольная биопсия.
4. Открытый доступ возможен:
1) при анатомически трудной локализации;
2) при отрицательной трепанобиопсии, скудности и малой информативности материала.
5. При открытом доступе выбирается стандартный оперативный̆ доступ.
6. Тактика разрабатывается совместно с хирургом-онкоортопедом, химиотерапевтом и, при необходимости, лучевым терапевтом.
7. Неправильный выбор места биопсии или нарушение техники ограничивает выбор способа мышечной пластики, повышает риск рецидива.
- биопсийного материала с целью верификации;
- операционного материала с целью оценки краев резекции, лечебного патоморфоза.
3. Лечение
1. Паростальная (юкстакортикальная) остеосаркома – только радикальное хирургическое лечение.
2. Периостальная остеосаркома:
- радикальное хирургическое лечение,
- консервативного лечения для перевода в резектабельное состояние.
3. Остеосаркома высокой степени злокачественности – комбинированное лечение:
- блок неоадъювантной терапии,
- радикальное хирургическое лечение,
- блок адъювантной терапии.
Органосохранные операции:
- при возможности отступа не менее 3–5 см,
- при условии отсутствия опухоли в костномозговом канале оставшейся части кости.
Главное условие операбельности - радикальность и абластичность удаления опухоли.
Ампутация или экзартикуляция конечности:
- обширное первично-множественное распространение,
- вовлечение магистрального сосудисто-нервного пучка, исключающее реконструктивно -пластический этап,
- прогрессирование на фоне предоперационной̆ терапии,
- отказ пациента от органосохранной операции,
- жизненные показания к экстренной хирургии – распад, кровотечение.
Использование модульных систем эндопротезирования.
Виды реконструктивных операций в объеме эндопротезирования:
1) стандартные первичные операции у взрослых;
2) стандартные первичные операции у детей̆ и подростков;
3) эндопротезирование редких анатомических зон;
4) ревизионное эндопротезирование.
Требования к эндопротезу для взрослых:
1) модульность конструкции;
2) максимальная надежность и ремонтопригодность;
3) универсальность компонентов;
4) максимальный срок службы;
5) стабильная фиксация;
6) хороший̆ функциональный̆ результат;
7) короткий̆ срок изготовления.
Особенности эндопротеза для детей̆ и подростков:
1) бесцементный способ фиксации;
2) раздвижной̆ механизм (инвазивный̆ и неинвазивный).
Реэндопротезирование проводят в медорганизациях с подготовленной командой онкологов, травматологов-ортопедов и хирургов с практическим опытом.
Индивидуальные системы протезирования, персонализированный инструментарий, прототипы операций при опухоли:
- костей таза,
- позвоночника,
- других сложных анатомических локализаций.
При использовании онкологических эндопротезов применяют длительные режимы профилактической антибиотикотерапии:
1) цефалоспорины 3 поколения + клиндомицин или ванкомицин 10 - 14 дней в стационаре,
2) пероральные в последующие 4 недели.
Факторы риска инфицирования:
- высокая злокачественность,
- глубокое расположение опухоли,
- иммунносупрессия от неоадъювантной ХТ,
- предшествующая ЛТ,
- неадекватная антибиотикопрофилактика,
- прием кортикостероидов,
- большая раневая поверхность,
- продолжительная операция (более 3 часов),
- кровопотеря более 0,5 объема циркулирующей крови,
- вторичное заживление раны,
- некрозы кожи,
- дополнительные хирургические манипуляции,
- сопутствующие заболевания (анемия, сахарный диабет и т.д.)
Калечащие операции (ампутации, экзартикуляции и др.):
- при технической невозможности радикальности R0 (R1),
- по витальным показаниям.
Хирургическая тактика не имеет принципиальных различий.
Комбинированное лечение при локализованной форме:
- предоперационная ХТ,
- операция,
- послеоперационная ХТ.
Предоперационная ХТ:
- улучшает результаты лечения;
- позволяет оценку in vivoактивности химиопрепаратов;
- облегчает выполнение операции;
- 3–4 цикла;
- при некрозе опухоли от 90% вероятность увеличения безрецидивной и общей̆ выживаемости.
При локализованной опухоли - 4 цикла AP:
- Доксорубицин 90 мг/м2 в/в, 96-часовая инфузия;
- Цисплатин 120 мг/м 2 в/в или в/а инфузия 1 день каждые 4 недели.
Послеоперационная ХТ - режим определяется по степени лекарственного патоморфоза:
- при III–IV степени - повторение АР, также 4 цикла,
- при меньшей степени некроза - 12 месяцев альтернирующих схем:
- 4 цикла HDI: ифосфамид 2 г/м 2 (с месной) в/в инфузия 1–7 дни, через 3 недели, КСФ 8–16 дни;
- через 3 недели – HD MTX: метотрексат 12 г/м 2 в/в (с кальция фолинатом), 4 введения с интервалом в 14 дней только для молодых пациентов.
- при явной низкой эффективности 2 курсов - смена на 2 курса высокодозного ифосфамида или высокие дозы метотрексата с кальция фолинатом;
- при крайне низкой степени лечебного патоморфоза возможны 2 курса гемцитабин 900мг/м 2 в 1, 8 дни + доцетаксел 100мг/м 2 8 день, филграстим 5 мкг/кг п/к 9-19 дни.
При нерезектабельной остеосаркоме 2-я и последующие линии ХТ:
- GemTax - Гемцитабин 900мг/м 2 в 1, 8 дни + Доцетаксел 100мг/м 2 в/в 8 день + филграстим 5мкг/кг п/к 9-19 дни, 2 цикла
- Сорафениб 400 мг х 2 раза в день, 3 месяца
Протонная терапия:
- самостоятельный метод при саркомах костей черепа, позвоночника, орбиты,
- после хирургического лечения при R1 и R2 краях резекции.
- не отличается от общепринятой̆ классификации для первичных опухолей̆ костей̆,
- при внекостной форме - как опухоли мягких тканей̆.
Радикальная операция - наилучший локальный контроль.
Локальное лечение из-за высокой̆ частоты метастазирования в кости и костный̆ мозг дополняется комбинированной̆ ХТ:
- 4 - 6 циклов индукционной̆ ХТ за 12–24 недель,
- после локального лечения 12 месяцев 6-10 циклов ХТ с 3-недельным интервалом.
Комбинация из 4-6 наиболее активных цитостатиков:
- доксорубицин,
- циклофосфамид,
- ифосфамид,
- винкристин,
- дактиномицин,
- этопозид.
Лучевая терапия:
- при невозможности радикального оперативного вмешательства,
- при недостаточном лечебном патоморфозе (более 10 % жизнеспособных клеток).
- СОД 40–45 Гр при микроскопических остаточных опухолях,
- СОД 50–60 Гр при макроскопических изменениях,
- дистанционная 3-D и интенсивно модулированная (IMRT) РОД = 2–2,5 Гр, СОД = 60 Гр с ХТ при отказе или нерадикальной операции,
- при метастазах в легкие – крупнопольная РОД = 2 Гр, СОД = 20 Гр.
ХТ - чередование режимов IE и VAC каждые 3–4 недели:
- IE:
- этопозид 100 мг/м 2 в/в 1–5 дни;
- ифосфамид 1,8 г/м 2 в/в инфузия 1–5 дни с месной.
- VAC:
- винкристин 2 мг/м 2 в/в 1 день;
- доксорубицин 75 мг/м 2 в/в 1 день;
- циклофосфамид 1200 мг/м 2 в/в 1 день.
При раннем прогрессировании - менее 1 года после завершения комбинированного лечения ХТ:
- циклофосфамид 250 мг/м 2 в/в 1–5 дни; топотекан 0,75 мг/м 2 в/в 1–5 дни; каждые 3–4 недели;
- этопозид 100 мг/м 2 в/в 1–5 дни; топотекан 0,75 мг/м 2 в/в 1–5 дни; каждые 3–4 недели;
- иринотекан 250 мг/м 2 в/в 6 день; темозоломид 150 мг/м 2 внутрь или в/в 1–5 дни; каждые 4 недели;
- GemTax: гемцитабин 900 мг/м 2 1, 8 дни 90-минутная инфузия; доцетаксел 100 мг/м 2 8день; КСФ п/к 9–19 дни.
Рекомендуется комбинированная ХТ в сочетании с возможным оперативным лечением.
Выбор 2-й линии ХТ зависит от первичного лечения:
- высокие дозы метотрексата, ифосфамид,
- не доказана эффективность этопозида,
- при метастазах через 6 месяцев после лечения, возможно повторение режима химиотерапии.
При метастатическом поражении легких возможно оперативное вмешательство с ХТ:
- метастазэктомия,
- повторная торакотомия.
ХТ при метастазах в легких:
- те же режимы в такой же последовательности, как при лечении первичной опухоли,
- 3-я и более линий терапии - сорафениб (нексавар) 400 мг 2 раза в сутки ежедневно.
При рецидиве саркомы Юинга - паллиативная терапия, за исключением ограниченного рецидива после длительного свободного периода.
Единственный прогностический фактор при рецидиве - время его возникновения, лучшие результаты при свободном периоде больше 2 лет.
- такая же стандартизированная ХТ, как при локализованной саркоме,
- остеогенной саркомы в легкие повышение выживаемости после резекции остаточных метастазов только после эффективной̆ ХТ и тотальной ЛТ легкого,
- в кости или костный̆ мозг 5-летняя выживаемость менее 20%,
- в кости показана ЛТ,
- интенсивные и высокодозные режимы ХТ с аутотрансплантацией костного мозга оправданы у отдельных пациентов,
- при местно-распространенной и/или метастатической гигантоклеточной опухоли кости таргетная терапия деносумабом 120мг п/к 1, 8, 15 и 28 дни, далее через 28 дней.

- Информация о Центре
- История ЦИТО
- ЦИТО сегодня
- Руководство
- Информация для пациентов
- Законодательство о медицине
- Документы и лицензии
- Медицинский туризм
- СМИ о нас
- Вакансии
- Новости
- Для благотворителей и партнеров
- Отделения
- Услуги и цены
- Врачи ЦИТО
- Наука
- Диссертационный совет Д208.112.02
- Члены диссертационного совета Д208.112.02
- Диссертационный совет Д208.112.01(Архив)
- Конкурсы на замещение научных должностей
- Статьи
- Журнал
- Клинические рекомендации
- Академия ЦИТО
- Образование
- Сведения об образовательной организации
- Документы. Приказы по учреждению
- Законодательные и нормативные правовые акты
- ПРИЁМНАЯ КАМПАНИЯ-2020
- Кафедра травматологии и ортопедии
- Дополнительное профессиональное образование
- Требования к государственной итоговой аттестации
- Бально-рейтинговая система оценки знаний ординаторов
- Телемедицина
- Для врачей
- Для пациентов
- Центры компетенций
- Центр инфекционной патологии
- Центр онкологической ортопедии
- Отзывы и вопросы
- Контакты
Хондросаркома — злокачественная опухоль, клетки которой продуцируют хрящ. Встречается относительно часто (составляет около 10% всех злокачественных опухолей костей). Обнаруживается в возрастной группе от 5 до 90 лет, в основном в среднем и пожилом возрасте — чаще между 40 и 60 годами (около 60% больных), с несколько большей частотой обнаруживается у мужчин. Выделяют по локализации — центральную (костномозговую) и периферическую (юкстакортикальную) формы, а также первичную и вторичную хондросаркомы – последняя развивается из предсуществующих доброкачественных опухолей, в основном из энхондром и остеохондром (особенно множественных). Вторичная хондросаркома встречается в более молодом возрасте (около 60% больных в возрасте 30–40 лет). Может поражаться любая кость хрящевого происхождения. Наиболее частая локализация (три четверти больных) — кости туловища (рёбра, грудина, таз) и верхние концы бедренной и плечевой костей; редко поражаются кости костей и стоп.
С диагностической точки зрения хондросаркомы подразделяют на хондросаркомы низкой (I), средней (II) и высокой (III) степени злокачественности. Почти 60–90% хондросарком относится к хондросаркомам низкой и средней степени злокачественности.
Клиническая картина. Периферические опухоли медленно увеличиваясь, не вызывая боли, достигают больших размеров; центральные опухоли — прогрессивно усиливающиеся боли.
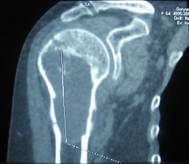
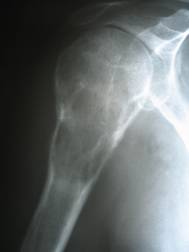
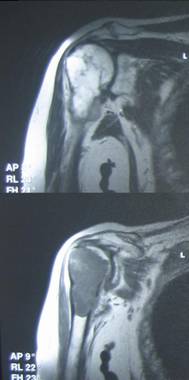
Рентгенологически выявляют в очаге деструкции участки обызвествления в виде крапчатости; кортикальный слой с признаками эрозии со стороны эндоста и истончения; размеры опухоли более 4 см; периостальная реакция слабо выражена или отсутствует; может наблюдаться деструкция кортикальной кости и наличие мягкотканного компонента; в длинных костях локализуется чаще в метафизах и диафизах; интенсивное внутрикостномозговое распространение.
Патоморфология.
Макроскопически гомогенная ткань голубовато-серого цвета, дольчатого строения, различных размеров узлы часто разделены узкими полосами фиброзной ткани, очаги миксоматозных изменений, обызвествления, некрозов.
Микроскопия. Хондроидный матрикс, в котором расположены хрящевые клетки различной степени дифференцировки и атипии, митозы не многочисленны (некоторые атипичны), двуядерные и многоядерные клетки, миксоматозные изменения. Хондроциты выстраиваются пучками или группами, ядра несколько увеличены, иногда причудливой формы. Матрикс варьирует от зрелого гиалинового хряща до миксоидной стромы. Митозы не определяются в хондросаркомах I, обнаруживаются в хондросаркомах II и многочисленны в хондросаркомах III степени злокачественности. В краях опухоль врастает в костномозговое пространство, распространяясь между костными трабекулами, при разрушении кортикальной пластинки прорастание опухоли в прилежащие мягкие ткани.
Хондросаркома низкой степени злокачественности цитологически очень схожа с энхондромой. Микроскопические отличия минимальны и в значительной степени субъективны, в связи с чем гистологическая диагностика хондросаркомы низкой степени злокачественности должна проводиться с обязательным учетом клинических данных и методов лучевой диагностики. По сравнению с энхондромой в хондросаркомах I несколько увеличена клеточность опухоли, определяются мономорфные хондроциты с маленькими, иногда слегка увеличенными плотными ядрами, отдельные двуядерные и многоядерные клетки, строма хондроидного типа с редкими миксоидными полями, микронекрозами.Хондросаркома промежуточной степени злокачественности, характеризуется более частым расположением клеток и более крупными размерами ядер хондроцитов, увеличенным числом двуядерных и многоядерных клеток, наличием отдельных патологических митозов, фокусов миксоидных изменений матрикса, некрозов.
Критерии злокачественности в хондросаркомах варьируют в зависимости от анатомической локализации патологического процесса. Так, значительная клеточная плотность, двуядерные клетки, гиперхромазия, миксоидные изменения матрикса могут наблюдаться в энхондромах мелких костей кисти и стопы, в периостальной хондроме, при хондроматозе и синовиальном остеохондроматозе. Почти без исключения хрящевые опухоли грудины являются злокачественными, не взирая на их гистологические проявления.
Дифференциальная диагностика. Хондрома, хондромиксоидная фиброма, хондробластический вариант остеосаркомы, хондроидная хордома.
Лечение. При хондросаркомах низкой или средней степени злокачественности обычно производится сегментарная резекция кости вместе с опухолью. Хондросаркомы высокой степени злокачественности требуют применения ампутации и экзартикуляции. Хондросаркома является резистентной к рутинной химио- и лучевой терапии, однако они могут применяться как составной элемент комплексного лечения или с паллиативной целью (нерадикальное хирургическое вмешательство, труднодоступная локализация опухоли).
Исход относительно удовлетворительный; выражена склонность к локальному рецидивированию; формы низкой степени злокачественности метастазируют редко и через длительное время после выявления заболевания, хондросаркомы высокой степени злокачественности метастазируют рано в лёгкие и другие органы. Пятилетняя выживаемость в среднем — 45–60%; при хондросаркомах I — 90% и снижается до 29% при хондросаркомах III степени злокачественности.
САРКОМА КОСТЕЙ. ОСТЕОСАРКОМА
Первичные опухоли костей редкая и разнородная группа новообразований человека. В структуре заболеваемости злокачественными новообразованиями они составляют менее 1 % у взрослых и до 10% — у детей. В последние два десятилетия достигнут большой прогресс в лечении этих заболеваний. Благодаря современной химиотерапии, совершенствованию методов визуализации опухолей костей и успехам онкологической ортопедии в настоящее время большинство пациентов могут быть излечены, при этом конечность удается сохранить более чем в 80% случаев.
Биологическая активность сарком костей (остеосарком) и вероятность их метастазирования во многом зависит от морфологических особенностей, в частности степени полиморфизма, атипии, количества митозов и зон спонтанного некроза. Учет этих критериев позволяет выделить остеосаркомы высокой, промежуточной и низкой степени злокачественности.
Саркомы костей формируют в рамках того или иного анатомического отдела опухолевые массы, которые по периферии отличаются наименьшей степенью дифференцировки. Они отделены от внескелетных тканей псевдокапсулой или реактивной зоной, состоящей из клеток опухоли, элементов фиброзной ткани и воспалительного компонента, коррелирующего со степенью злокачественности. В результате прогрессирующего роста остеосаркома выходит за рамки одного отдела и вовлекает анатомические структуры соседнего отдела.
У большинства пациентов в момент установления диагноза остеосаркома поражены два анатомических отдела. Близлежащие суставные поверхности вовлекаются в опухолевый процесс редко, чаще это наступает при патологических переломах.
Саркомы костей высокой степени злокачественности метастазируют преимущественно гематогенно. Чаще всего метастазами поражаются легкие (более 80%), причем уже на ранних стадиях развития заболевания, т.е. до начала лечения. Костные метастазы наблюдаются редко (до 10%), особенно при запущенных опухолях. Метастатические поражения регионарных лимфатических узлов встречается в 7—10% случаев.
Процесс стадирования, влияющего на выбор тактики лечения, вида операции и оценку прогноза, включает определение степени злокачественности остеосаркомы, степени местной распространенности и наличия отдаленных метастазов.
Стандартная рентгенография — наиболее распространенный и доступный метод визуализации сарком костей (рис. 1). В специализированных клиниках точность установления диагноза и стадии процесса превышает 80%.
Компьютерная томография позволяет более точно оценить степень деструкции кости и структурные особенности внутрикостного и внекостного компонентов опухоли (рис. 2). КТ органов грудной клетки дает представление о наличии метастазов в легких и лимфатических узлах средостения.
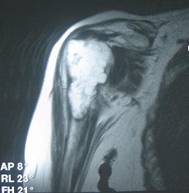
С помощью МРТ удается лучше оценить распространение опухоли внутри кости а также степень вовлечения внескелетных тканей (рис. 3).
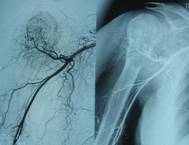
При местно-распространенных опухолях, когда есть подозрения в отношении вовлечения магистральных сосудов, выполняется ангиография (рис. 4).
Планарная сцинтиграфия дает возможность определить распространенность опухоли по длине кости, а также выявляет отдаленные метастазы остеосаркомы в скелете (рис. 5).
При саркоме Юинга более точно наличие костных метастазов можно установить с помощью ПЭТили ПЭТ/КТ (рис. 6).
Широкое распространение среди специалистов получила классификация, разработанная в начале 80-х годов прошлого века американским исследователем W. Enneking. Впоследствии она была одобрена американским и европейским обществами по изучению костно-мышечных опухолей в качестве рабочей классификации. При стадировании опухолей костей по Enneking учитываются следующие критерии: G — степень злокачественности (G1-2 — низкая степень; G3-4 — высокая). Т — местная распространенность (Т1 — в пределах кости; Т2 — выход за пределы кортикального слоя) М — отдаленные метастазы (М0 — без метастазов; М1 — отдаленные метастазы). В таблице 1. представлена система стадирования опухолей костей по W. Enneking.
| Таблица 1. Стадирование опухолей костей по Enneking | |||
|---|---|---|---|
| Стадия IА | G1, 2 | T1 | М0 |
| Стадия IВ | G1, 2 | T2 | М0 |
| Стадия IIА | G3, 4 | T1 | М0 |
| Стадия IIB | G3, 4 | T2 | М0 |
| Стадия IIIА | G3, 4 | T1 | М1 |
| Стадия IIIВ | G3, 4 | T2 | М1 |
Классическая остеосаркома, опухоли семейства саркомы Юинга, а также ЗФГ относятся по определению к G3-4, т. е. ко II-ой стадии.
Для стадирования и определения тактики лечения остеосаркомы используется также классификация по системе TNM (табл. 2).
ТX — Недостаточно данных для оценки первичной опухоли
Т0 — Первичная опухоль не определяется
Т1 — Опухоль ограничена кортикальным слоем
Т2 — Опухоль распространяется за кортикальный слой
Как в классификации Enneking, так и в системе стадирования ВОЗ выделение критериев T3 и T4 признано нецелесообразным.
NX — Недостаточно данных для определения регионарных лимфатических узлов
N0 — Нет признаков метастатического поражения регионарных лимфатических узлов
N1 — Регионарные лимфатические узлы поражены метастазами
M — Отдаленные метастазы
М0 — Нет признаков отдаленных метастазов
М1 — Имеются отдаленные метастазы
Также учитывается степень дифференцировки опухоли (критерий G)
G1 — Высокая степень дифференцировки
G2 — Средняя степень дифференцировки
G3 — Низкая степень дифференцировки
G4 — Недифференцированные опухоли
| Таблица 2. Группировка опухолей костей по стадиям | ||||
|---|---|---|---|---|
| Стадия IА | G1, 2 | T1 | N0 | M0 |
| Стадия IВ | G1, 2 | T2 | N0 | M0 |
| Стадия IIА | G3, 4 | T1 | N0 | M0 |
| Стадия IIB | G3, 4 | T2 | N0 | M0 |
| Стадия III | Не определяется | |||
| Стадия IVА | любое G | любое Т | N1 | M0 |
| Стадия IVВ | любое G | любое Т | любое N | М1 |
Практически все злокачественные новообразования скелета в связи с их относительной редкостью создают в клинической практике значительные трудности, как в диагностическом, так и лечебном отношении. Врачи первичной лечебной сети в массе своей вообще плохо знакомы с этой областью онкопатологии, что нередко ведет на первых этапах обращения больных с нечеткими клиническими симптомами к постановке ошибочных диагнозов и назначению неадекватных лечебных мероприятий. Одной из главных проблем в этой области патологии является морфологическая верификация диагноза, которая абсолютно необходима для выбора режима ведения больных с саркомой костей, назначения лечебных мероприятий, осуществления контроля их эффективности и оценки прогноза заболевания.
В клинической онкологии особое значение приобрели вопросы классификации или уточненной нозологической систематики отдельных форм опухолевого поражения. В диагностическом и лечебном отношении эти классификационные схемы совершенно необходимы. Основным принципом классификаций опухолей является их гистологическое строение, которое в значительной мере отражает их гистогенез или тканевую принадлежность и в части случаев позволяет судить о степени их злокачественности. Классификации унифицируют признаки опухолей, что позволяет различным специалистам оценивать их с общих позиций и избегать разногласий в диагностической и лечебной трактовке.
Наиболее распространенной классификацией сарком костей в настоящее время считается классификация ВОЗ пересмотра 2002 года.
Следует особо подчеркнуть, что каждый патологоанатом, приступая к диагностике поражений скелета и, в первую очередь, костных опухолей, непременно должен лично ознакомиться с радиологическими данными (рентгенограммы, КТ и МРТ). До начала гистологического исследования патолог должен иметь представление о локализации поражения в пределах кости, его размерах, форме, степени разрушения костной структуры, наличии или отсутствии реактивных изменений в надкостнице и прилежащих мягких тканях. Полученная таким образом информация может в большинстве случаев оказаться весьма важной при диагностическом исследовании тканевого материала из очага поражения под микроскопом.
Читайте также:


