Диагностика гранулематозных васкулитов анф и анца
Диагностика гранулематозного васкулита включает в себя выявление в крови пациента антинуклеарного фактора на HEp-2 клетках, антител к цитоплазме нейтрофилов.
Антинуклеарный фактор (АНФ), антиядерные антитела, антинуклеарные антитела (АНА), антитела к цитоплазме нейтрофилов, АНЦА.
Синонимы английские
ANCA, аntinuclear аntibodies (ANA), Hep-2 Substrate, ANA-Hep2, аnti-neutrophilic/cytoplasm antibody.
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
В медицинской практике определение в крови пациента антинуклеарного фактора на HEp-2 клетках, антител к цитоплазме нейтрофилов применяется для диагностики гранулематозного васкулита.
Исследование рекомендуется проводить при обследовании пациентов с подозрением на гранулематозный васкулит, выявлении астмы, синусита, мигрирующей инфильтрации в легких, сердечной недостаточности, миокардита, пурпуры, гломерулонефрита, почечной недостаточности, желудочно-кишечного кровотечения неясной природы, ишемии кишечника с перфорацией. А также при необходимости установления причин лихорадки, болей в мышцах и суставах, мононевритов, полинейропатии конечностей, для дифференциальной диагностики с другими аутоиммунными заболеваниями, мониторинга эффективности терапии, прогнозирования вероятности рецидивов заболевания.
Гранулематозный васкулит (синдром Чарга – Стросс, аллергический гранулематозный ангиит, эозинофильный гранулематоз с полиангиитом) – редкое неизлечимое заболевание, связанное с воспалительным поражением кровеносных сосудов (мелкого и среднего калибра), расположенных в различных органах тела. Из-за воспалительных изменений в сосудах может нарушаться кровоток в жизненно важных органах (сердце, легкие, почки, головной мозг).
Наиболее частым клиническим признаком синдрома Чарга – Стросс является бронхиальная астма. Однако заболевание характеризуется разнообразными клиническими проявлениями: высокая лихорадка, сыпь на коже, желудочно-кишечное кровотечение, сильные боли и онемение кистей и стоп.
Точные причины развития заболевания до сих пор неизвестны. Вероятно, гиперреактивность иммунной системы при данной патологии провоцируется совокупностью генетической предрасположенности и воздействия на организм факторов окружающей среды (аллергены, некоторые лекарственные препараты). Возможными факторами риска развития синдрома Чарга – Стросс являются возраст старше 40 лет, бронхиальная астма или частые риниты в анамнезе.
Общепринятыми являются 6 диагностических критериев гранулематозного васкулита: астма, повышение количества эозинофилов в периферической крови более 10 %, синусит, инфильтрация в легких (возможно, преходящая), гистологическая верификация, мононевриты или полинейропатия конечностей. При наличии 4 из 6 диагностических признаков можно говорить о том, что пациент страдает гранулематозным васкулитом.
В течении заболевания выделяют 3 фазы: аллергический ринит и астма, эозинофильная пневмония или гастроэнтерит, системное поражение кровеносных сосудов с гранулематозным воспалением.
Фаза васкулита обычно развивается в течение 3 лет от начала заболевания, клинически это проявляется патологией легких (астмой, пневмонитом), верхних дыхательных путей (аллергическим ринитом, синуситом, полипозом носовой полости), сердечно-сосудистой системы (сердечная недостаточность, миокардит, инфаркт миокарда), кожи (пурпура, сыпь), почек (гломерулонефрит, гипертензия, почечная недостаточность), полинейропатия конечностей, пищеварительной системы (желудочно-кишечное кровотечение, ишемия кишечника с перфорацией, аппендицит, панкреатит, холестаз), лихорадка, боли в мышцах и суставах.
В настоящее время не существует специфических исследований для выявления гранулематозного васкулита. При обследовании пациентов с подозрением на синдром Чарга – Стросс необходимо проводить следующие обследования: исследование в крови пациента антител к цитоплазме нейтрофилов (положительно у 70 % больных), уровня эозинофилов, выполнение клинического и биохимического анализов крови, обзорной рентгенографии органов грудной клетки, компьютерной томографии легких, бронхоскопии, биопсии легких.
Лечение гранулематозного васкулита является поддерживающим и направлено на достижение устойчивой ремиссии и увеличение продолжительности жизни таких пациентов. Для этого применяются глюкокортикостероиды, циклофосфамид, азотиаприн, внутривенное введение иммуноглобулинов, альфа-интерферона и проведение плазмафереза.
Залог успешного лечения этой группы больных – ранняя диагностика заболевания и назначение адекватной терапии. При отсутствии лечения пятилетняя выживаемость пациентов при данной патологии составляет 25 %.
Для чего используется исследование?
- Для обследования пациентов при подозрении на гранулематозный васкулит;
- для дифференциальной диагностики с другими аутоиммунными заболеваниями;
- для мониторинга эффективности терапии;
- для прогнозирования рецидивов заболевания.
Когда назначается исследование?
- При выявлении у пациента астмы, повышения количества эозинофилов в периферической крови более 10 %, синусита, инфильтрации в легких (возможно преходящей), сердечной недостаточности, миокардита, пурпуры, гломерулонефрита, почечной недостаточности, желудочно-кишечного кровотечения неясной природы, ишемии кишечника с перфорацией;
- при необходимости установления причин лихорадки, болей в мышцах и суставах, мононевритов или полинейропатии конечностей.
Что означают результаты?
1. Антинуклеарный фактор
Титр: Что может влиять на результат?
Вероятность ложноположительного результата исследования повышается у пожилых людей, больных злокачественными новообразованиями, хроническими заболеваниями или инфекциями.
Длительное лечение преднизолоном вызывает побочные эффекты, которые можно минимизировать, выполняя следующее: контролировать вес тела, заниматься физкультурой, прекратить курение, придерживаться здоровой диеты, соблюдать назначения врача.
- 23 Антинуклеарный фактор на HEp-2 клетках
- 14 Антитела к ядерным антигенам (ANA), скрининг
- 56 Антинуклеарные антитела, IgG (анти-Sm, RNP, SS-A, SS-B, Scl-70, PM-Scl, PCNA, CENT-B, Jo-1, гистонов, нуклеосом, Ribo P, AMA-M2), иммуноблот
- 37 Антитела к экстрагируемому ядерному антигену (ENA-скрин)
- 20 С-реактивный белок, количественно (высокочувствительный метод)
- 6 Общий анализ крови
- 8 Лейкоцитарная формула
- 5 Скорость оседания эритроцитов (СОЭ)
- 15 Ревматоидный фактор
- 40 Клинический и биохимический анализ крови - основные показатели
- 14 Общий анализ мочи с исследованием осадка методом проточной цитофлуориметрии
- 15 Белок общий в моче
Кто назначает исследование?
Ревматолог, пульмонолог, терапевт, врач общей практики.
![]()
Васкулиты представляют собой широкий спектр заболеваний имеющих разнообразную природу. Среди них первичные васкулиты имеют аутоиммунную этиологию, а другие процессы являются вторичными по отношению к опухолям, инфекциям и коагулопатиям.
На основании классификации Chapel Hill 2012 года прервичные васкулиты делят по калибру пораженных сосудов и механизму иммунологического поражения. В основе патогенеза васкулитов крупных сосудов, к которым относятся аортоартериит Такаясу и височный артериит, лежит поражение сосудистой стенки, что обуславливает большую площадь вовлеченного эндотелия. Одной из причин воспаления сосудистой стенки является индукция антител к эндотелию (HUVEC). Синтез эндотелием провоспалительных цитокинов, прежде всего TNFa и IL-6, приводит к формированию выраженного острофазового ответа, выявление которого широко используется в диагностике васкулитов крупных сосудов. Так при аортоартерите Такаясу, височном артериите отмечаются чрезвычайно высокие уровни СРБ и значительно повышенные значения СОЭ.
Узелковый полиартериит является редкой формой системных васкулитов. Он может развиться в течении 1 года после перенесенного вирусного гепатита В. Обычно представляет собой самолимитирующее заболевание, которое рецидивирует крайне редко. Несмотря на то, что морфологически он проявляется гранулематозным воспалением, сходным с гранулемами при микроскопическом полиангиите, антинейтрофильные антитела (АНЦА) и другие специфические серологические маркеры при классическом узелковом полиартериите отсуствуют. Обычно его обострение сопровождается гипокомплементемией (С3 и С4), а также увеличением концентраций острофазовых белков (СРБ). В сыворотке крови пациентов обычно обнаруживают признаки текущей инфекции гепатита В в виде наличия антигенов HBsAg и HBeAg.
Болезнь Кавасаки поражает преимущественно детей до 10 лет. Клинические проявления включают лихорадку, лимфаденопатию, кожную сыпь, характерное покраснение языка и слизистой рта, а также васкулит, поражающий коронарные артерии. Большая часть случае болезни Кавасаки возникает спорадически, однако описаны вспышки этого заболевания, которые указывают на ее инфекционный характер. Антиэндотелиальные антитела отмечаются у 90% пациентов при этом заболевании и коррелируют с его активностью.
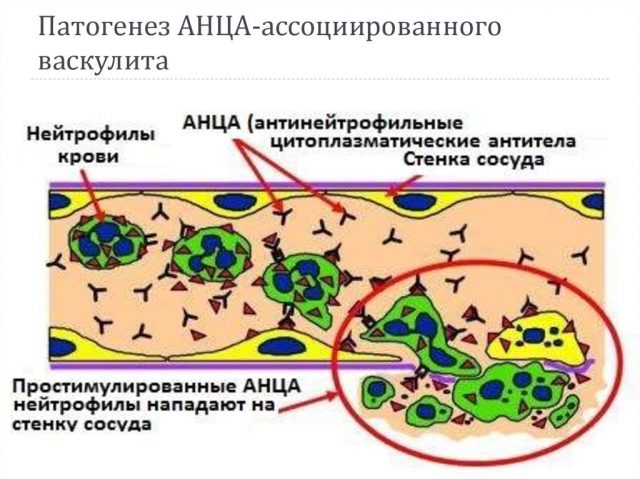
Гранулематозные васкулитах мелких сосудов имеют ряд общих черт, к которым относят поражение почек по типу олигоиммунного экстракапиллярного гломерулонефрита с полулуниями, полиневрит и легочный капиллярит. Основным методом серологической диагностики гранулематозных васкулитов является обнаружение антинейтрофильных цитоплазматических антител (АНЦА). Антитела этого семейства реагируют с белками азурофильных гранул нейтрофильных гранулоцитов. Значение АНЦА в патогенезе и диагностике гранулематозных васкулитов, позволило выделить отдельную группу, обобщенных под названием АНЦА-ассоциированные васкулиты. К ним относятся гранулематоз Вегенера, синдром Чарг-Штраусса, микроскопический полиартериит, быстропрогрессирующий гломерулонефрит с полулуниями.
По аналогии с выявлением антинуклеарного фактора (АНФ), при флюоресцентной микроскопии для обнаружения АНЦА можно отметить несколько типов свечения цитоплазмы клеток. С помощью метода иммунофлюоресценции отмечается два основных типа свечения АНЦА – цитоплазматический (цАНЦА) и перинуклеарный (пАНЦА), которые зависят от клеточных мишеней нейтрофильных антитител, поэтому имеет важное значение в постановке диагноза. Каждому из типов свечения соответствуют свои антигенные мишени. Для описания типов свечения обычно используются сокращения – цАНЦА и пАНЦА. Кроме того, могут выявляться нетипичные варианты антинейтрофильных антител. Целесообразно выявлять АНЦА совместно с АНФ, так как последние могут маскировать АНЦА.
При цитоплазматическом типе свечения (цАНЦА) основным антигеном является протеиназа 3 (ПР-3), реже причиной становятся антитела к другим ферментам гранул, прежде всего белку BPI. При выявлении перинуклеарного типа иммунофлюоресценции (пАНЦА), несколько чаще выявляются антитела против миелопероксидазой (МПО) – основного микробицидного фермента азурофильных гранул, генерирующим кислородные радикалы. Реже выявляются антитела к другим ферментам нейтрофильных гранул, таких как лактоферрин, эластаза и каптепсин G. Кроме того, при исследовании антинейтрофильных антител нередко выявляются высокие титры антинуклеарного фактора, что требует уточнения серологического спектра с помощью дополнительных тестов. Для повышения чувствительности серологического обследования пациентов с системными васкулитам действующие международные рекомендации требуют одновременного использования иммунофлюоресцентного теста, а также выявления антител к протеиназе-3 и антител к миелопероксидазе (Антинейтрофильные антитела (АНЦА, аМПО и аПР3).
К известным антигенным мишеням АНЦА относят протеиназу-3, лизоцим, миелопероксидазу, лактоферрин, эластазу, белок BPI и катепсин G. Разработанная ИФА панель антигенов позволяет в одном тесте выявить антитела к 7 антигенам и полуколичественно исследовать содержание каждого из них (Антитела к антигенам цитоплазмы нейтрофилов).
К группе заболеваний АНЦА-ассоциированых васкулитов иногда относят синдром Гудпасчера, так как АНЦА могут отмечаться у 10-15% пациентов с этим заболеванием, совместно с антителами к базальной мембране клубочка (БМК), выявление которых являются основным лабораторным методом его диагностики. Хотя синдром Гудпасчера не является системным васкулитом, он проявляется геморраггическим альвеолитом и быстропрогрессирующим гломерулонефритом, который сложно отличить от АНЦА-ассоциированного поражения почек. В связи с этим, выявление АНЦА и антитела к базальной мембране почек обычно используется совместно.
Иммунокомплексные васкулиты обусловлены образованием иммунных комплексов между аутоантителами и их антигенами в крови и сосудистой стенке. Иммунные комплексы, которые можно обнаружить в сыворотке крови называют циркулирующими иммунными комплексами (ЦИК). Предполагается, что снижение растворимости ЦИК приводит к их отложению в сосудистой стенке и развитию воспаления. Снижение растворимости при замедлении скорости кровотока и температуры приводит к тому, что иммунными комплексами поражаются преимущественно капилляры, прежде всего капилляры кожи. Криоглобулинемический васулит сопровождается появлением в крови криоглобулинов – резновидности ЦИК, которые преципитирую при температуре ниже 35-30 градусов Цельсия. К сожалению тесты, направленные на прямое определение ЦИК очень не специфичны и не рекомендуются для практического использования и постановки диагноза.
Другим механизмом поражения кожи являются антитела к С1q фактору комплемента, которые стабилизируют С3-конвертазу и приводят к активации комплемента в стенках мелких сосудах. Выявление повышенного содержания аутоантител к C1q у больного с кожным васкулитом указывает на диагноз гипокомплементемического васкулита. При системной красной волчанке обнаружение антител к C1q определяет риск гломерулонефрита. Увеличение содержания в динамике может отмечаться перед обострением волчаночного нефрита.
Отдельно выделяют методы позволяющие обнаружить отложения иммунных комплексов и комплемента непосредственно в пораженной ткани. Обнаружение отложений иммунных комплексов в ткани с помощью иммунофлюоресцентного исследования биопсии кожи позволяет объективизировать иммуннокомплексный процесс и обладает большей достоверностью, по сравнению с методами выявления ЦИК.
До недавнего времени отсутствие других диагностических подходов, кроме клинических и морфологических, в значительной мере затрудняло их выявление. Это нередко приводило к диагностическим ошибкам в связи с полиморфной клинической картиной и сходством симптоматики с системными заболеваниями соединительной ткани и другими неревматическими заболеваниями. Проведение иммунологического обследования на раннем этапе позволяет сократить время постановки окончательного диагноза и избавить от анализа зачастую неоднозначных клинических данных.
Диагностические тесты при васкулитах сосудов различного калибра
Среди всех разновидностей васкулитов самыми опасными считаются АНЦА-ассоциированные васкулиты (ААВ). Такие системные патологии характеризуются наличием в крови пациента антинейтрофильных цитоплазматических антител (АНЦА).
В ходе развития патологий страдают в основном мелкие кровеносные сосуды. Но это не значит, что болезнь можно не воспринимать серьезно. Коварен ассоциированный васкулит АНЦА своим мгновенным стремительным течением.
То есть пострадавшие органы критически недополучают питания, а в результате развиваются необратимые некротические процессы. Код патологии по МКБ — М 31.3 и М 31.8. Как проявляется АНЦА васкулит и как его лечат, разбираем ниже.
Подвиды АНЦА васкулитов
К васкулитам АНЦА в медицине относят несколько разновидностей васкулитов. Каждый из них поражает определенные органы и крайне опасен для организма человека. Выделяют такие разновидности ААВ:
- Гранулематоз Вегенера. В этом случае страдают респираторные пути: слизистые органов слуха, зрения и дыхания. В некоторых случаях поражаются даже легкие. Болезнь развивается крайне стремительно. Если не принять меры, летальный исход наступает уже в течение первых 6–12 месяцев от начала патологии. Гранулематоз Вегенера бывает генерализованным и локальным. В некоторых случаях медики считают эти виды стадиями болезни. В ходе гранулематоза Вегенера на слизистых пациента образуются своеобразные наросты по типу полипов. С течением болезни они распадаются, образуя кровоточащие раны. Именно поэтому у пациента иногда выявляют легочное или иное кровотечение.
Важно: В некоторых случаях у пациентов страдают почки. Поражение мочевыделительных органов приводит к развитию быстропрогрессирующего гломерулонефрита. Почки некротизируются максимально быстро.
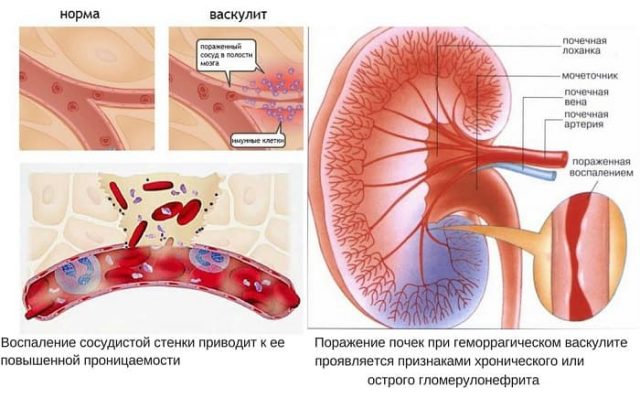
- Микроскопический полиангиит (МПА). Страдают мелкие и реже средние кровеносные сосуды внутренних органов. В основном поражаются почки, легкие, желудочно-кишечный тракт. В ходе прогрессирования болезни возникают внутренние кровотечения в легких, почках, органах ЖКТ. Иногда отмечаются неврологические симптомы заболевания в виде мононеврита. Сердце при МПА страдает реже.
- Эозинофильный гранулематозный полиартериит (ЭГПА). Болезнь еще называют синдромом Черджа–Стросс. В ходе такой разновидности АНЦА-васкулита страдают респираторные органы. Гранулемы на слизистой имеют выраженную эозинофильную инфильтрацию. То есть на слизистой образуются уплотнения и наросты из подвида лейкоцитов — эозинофилов.
Все виды ААВ являются серьезной проблемой для современной медицины, поскольку на начальных этапах заболевание практически никак не проявляется. Позднее, при явных признаках и симптомах, болезнь схожа со многими патологиями, что затрудняет проведение дифференциальной диагностики. Пока теряется драгоценное время на постановку диагноза, пациент как минимум превращается в инвалида. В худшем случае наступает летальный исход.
Механизм развития патологии
Все ААВ происходят на фоне аутоиммунных процессов в организме. По невыявленным причинам организм пациента начинает вырабатывать аутоантитела к клеткам кровеносных сосудов. В результате развивается воспаление стенок сосудистого русла. Просвет сосудов сильно сужается, что препятствует нормальному питанию органов-мишеней. От этого возникает ишемия тканей, питаемых данными сосудами. На фоне ишемии у пациента начинается некроз тканей и как следствие полный отказ органа.
Ученые выделяют несколько форм развития ААВ:
- Ограниченная. Характеризуется поражением исключительно верхних дыхательных путей.
- Генерализованная ранняя. Поражаются лишь сосуды без признаков нарушения работы внутренних органов.
- Генерализованная активная. Явно проявляются сбои в работе внутренних органов.
- Тяжелая. Налицо тяжелая декомпенсированная недостаточность внутренних органов на фоне васкулита АНЦА.
- Рефрактерная. Считается окончательной, поскольку добиться ремиссии при ней уже не удается даже на фоне грамотного и своевременного лечения.
Симптомы болезни
В зависимости от классификации ААВ клиническая картина при разных его видах гетерогенна, то есть разнообразна. Выглядит симптоматика так:
- ГВ (гранулематоз Вегенера). Начало патологии характеризуется проявлением общей слабости и потерей аппетита. Позднее присоединяются повышенная температура тела, миалгия и слабость суставов (артралгия). Далее симптоматика зависит от пострадавшего органа-мишени. Если это глаза, то страдают радужка и белочная оболочка. Если это дыхательные пути, то сначала проявляется устойчивый насморк с гнойными выделениями. Не исключена перфорация носовой перегородки. Могут появиться кровохарканье, язвенный стоматит, гнойные выделения из ушей по типу отита. При поражении легких у пациента отмечаются одышка, плеврит и пр. Если же мишенью ГВ стали почки, то у пациента в моче явно видна кровь, отмечена высокая концентрация белка и при этом анализ на гемоглобин отрицательный. То есть его уровень критически снижен.
- Микроскопический полиангиит (МПА). В большинстве случаев у пациента проявляются поражения почек в виде стремительно прогрессирующего гломерулонефрита. Симптомы — кровь в моче, повышенный белок, болезненность в области поясницы. При поражении органов ЖКТ не исключен стул с примесью крови или рвотные массы с кровью.
- ЭГПА. В этом случае ко всем приведенным выше симптомам примешивается эозинофильный мио- или эндокардит, перикардит, гипертензия артериальная. На коже проявляются подкожные узелки, папулы. Со временем из папул образуются язвы. Отмечаются боли в животе при поражении органов ЖКТ.
Важно: причинами летальных исходов при ААВ становятся острая почечная или сердечная недостаточность, остановка кровообращения, сильное внутреннее кровотечение, дыхательная недостаточность.
Диагностика заболевания
Для постановки точного диагноза следует сделать анализ крови на антинейтрофильные цитоплазматические антитела. В 50 % случаев у больного выявляют миелопероксидазу АНЦА, в 40 % случаев — протеиназу-3 АНЦА. И лишь в 10 % случаев результат является отрицательным.
Далее для подтверждения или опровержения диагноза нужно выполнить:
- общие анализы крови и мочи;
- КТ или МРТ пораженного органа;
- рентгеноконтрастное ангиологическое исследование;
- биопсию легких или почек (в зависимости от подозрений на орган-мишень).
Крайне важна дифференциальная диагностика, в ходе которой различают ГВ и синдром Черджа-Стросса (в первом случае астма отсутствует, во втором — присутствует). Также нужно исключить и другие патологии, при которых отмечается почечно-легочный синдром. В частности, это синдром Гудпасчера, васкулит системный, периартериит узелковый, васкулит геморрагический, красная волчанка системная, ангиоцентрическая злокачественная лимфома, образования злокачественные, сифилис и проказа, микоз, туберкулез, бериллиоз и др.
Важно: При ГВ в крови пациента выявляют антитела к протеиназе-3, в то время как при ЭГПА и при МПА у больного в крови повышена концентрация антител к миелопероксидазе.
Лечение патологии
Главной целью лечения системного васкулита АНЦА является достижение стойкой ремиссии. Поэтому терапию делят на три этапа:
- Индукция ремиссии. Здесь используют в основном глюкокортикоиды типа преднизолон и метилпреднизолон. Препараты вводят внутривенно методом капельниц и внутрь в виде таблеток. Как правило, улучшение наступает в течение первых трех недель лечения. Но расслабляться не стоит. Поддерживающая терапия показана каждые четыре недели.
- Поддержание ремиссии. На этом этапе продолжают введение циклофосфамида для поддержания стойкого результата. Также используют препараты метотрексат или азатиоприн. На сегодняшний день ученые изучают эффективность лефлуномида и микофенолата мофетила.
- Терапия эскалационная. Направлена на восстановление функций пострадавшего органа. Лечение подбирают в зависимости от сложности состояния пациента и внутреннего органа-мишени.
Общие прогнозы для пациентов с васкулитами АНЦА
В целом прогноз для пациентов с васкулитом АНЦА сложно назвать благоприятным. Но с усовершенствованием современной медицины показатели улучшаются. Жизненный прогноз для больных с ААВ зависит от формы развития болезни, своевременности поставленного диагноза и адекватности назначенного лечения. Кроме того во внимание стоит брать общее состояние организма пациента, его возраст и наличие дополнительных хронических заболеваний. Если говорить сухими цифрами, то прогноз для пациентов с ААВ выглядит так:
- Выживаемость при гранулематозе Вегенера в первый год от постановки диагноза составляет почти 85 %.
- В первые пять лет при ГВ выживаемость составляет около 65 %, при синдроме Черджа-Стросса около 65–70 %, при МПА — 46–54 %.
Важно: патология очень коварна и провоцирует летальность в первые 1–5 лет от момента выявления болезни.
Среди всех разновидностей васкулитов самыми опасными считаются АНЦА-ассоциированные васкулиты (ААВ). Такие системные патологии характеризуются наличием в крови пациента антинейтрофильных цитоплазматических антител (АНЦА).
В ходе развития патологий страдают в основном мелкие кровеносные сосуды. Но это не значит, что болезнь можно не воспринимать серьезно. Коварен ассоциированный васкулит АНЦА своим мгновенным стремительным течением.
То есть пострадавшие органы критически недополучают питания, а в результате развиваются необратимые некротические процессы. Код патологии по МКБ — М 31.3 и М 31.8. Как проявляется АНЦА васкулит и как его лечат, разбираем ниже.
Подвиды АНЦА васкулитов
К васкулитам АНЦА в медицине относят несколько разновидностей васкулитов. Каждый из них поражает определенные органы и крайне опасен для организма человека. Выделяют такие разновидности ААВ:
- Гранулематоз Вегенера. В этом случае страдают респираторные пути: слизистые органов слуха, зрения и дыхания. В некоторых случаях поражаются даже легкие. Болезнь развивается крайне стремительно. Если не принять меры, летальный исход наступает уже в течение первых 6–12 месяцев от начала патологии. Гранулематоз Вегенера бывает генерализованным и локальным. В некоторых случаях медики считают эти виды стадиями болезни. В ходе гранулематоза Вегенера на слизистых пациента образуются своеобразные наросты по типу полипов. С течением болезни они распадаются, образуя кровоточащие раны. Именно поэтому у пациента иногда выявляют легочное или иное кровотечение.
Важно: В некоторых случаях у пациентов страдают почки. Поражение мочевыделительных органов приводит к развитию быстропрогрессирующего гломерулонефрита. Почки некротизируются максимально быстро.

- Микроскопический полиангиит (МПА). Страдают мелкие и реже средние кровеносные сосуды внутренних органов. В основном поражаются почки, легкие, желудочно-кишечный тракт. В ходе прогрессирования болезни возникают внутренние кровотечения в легких, почках, органах ЖКТ. Иногда отмечаются неврологические симптомы заболевания в виде мононеврита. Сердце при МПА страдает реже.
- Эозинофильный гранулематозный полиартериит (ЭГПА). Болезнь еще называют синдромом Черджа–Стросс. В ходе такой разновидности АНЦА-васкулита страдают респираторные органы. Гранулемы на слизистой имеют выраженную эозинофильную инфильтрацию. То есть на слизистой образуются уплотнения и наросты из подвида лейкоцитов — эозинофилов.
Все виды ААВ являются серьезной проблемой для современной медицины, поскольку на начальных этапах заболевание практически никак не проявляется. Позднее, при явных признаках и симптомах, болезнь схожа со многими патологиями, что затрудняет проведение дифференциальной диагностики. Пока теряется драгоценное время на постановку диагноза, пациент как минимум превращается в инвалида. В худшем случае наступает летальный исход.
Механизм развития патологии
Все ААВ происходят на фоне аутоиммунных процессов в организме. По невыявленным причинам организм пациента начинает вырабатывать аутоантитела к клеткам кровеносных сосудов. В результате развивается воспаление стенок сосудистого русла. Просвет сосудов сильно сужается, что препятствует нормальному питанию органов-мишеней. От этого возникает ишемия тканей, питаемых данными сосудами. На фоне ишемии у пациента начинается некроз тканей и как следствие полный отказ органа.
Ученые выделяют несколько форм развития ААВ:
- Ограниченная. Характеризуется поражением исключительно верхних дыхательных путей.
- Генерализованная ранняя. Поражаются лишь сосуды без признаков нарушения работы внутренних органов.
- Генерализованная активная. Явно проявляются сбои в работе внутренних органов.
- Тяжелая. Налицо тяжелая декомпенсированная недостаточность внутренних органов на фоне васкулита АНЦА.
- Рефрактерная. Считается окончательной, поскольку добиться ремиссии при ней уже не удается даже на фоне грамотного и своевременного лечения.

Симптомы болезни
В зависимости от классификации ААВ клиническая картина при разных его видах гетерогенна, то есть разнообразна. Выглядит симптоматика так:
- ГВ (гранулематоз Вегенера). Начало патологии характеризуется проявлением общей слабости и потерей аппетита. Позднее присоединяются повышенная температура тела, миалгия и слабость суставов (артралгия). Далее симптоматика зависит от пострадавшего органа-мишени. Если это глаза, то страдают радужка и белочная оболочка. Если это дыхательные пути, то сначала проявляется устойчивый насморк с гнойными выделениями. Не исключена перфорация носовой перегородки. Могут появиться кровохарканье, язвенный стоматит, гнойные выделения из ушей по типу отита. При поражении легких у пациента отмечаются одышка, плеврит и пр. Если же мишенью ГВ стали почки, то у пациента в моче явно видна кровь, отмечена высокая концентрация белка и при этом анализ на гемоглобин отрицательный. То есть его уровень критически снижен.
- Микроскопический полиангиит (МПА). В большинстве случаев у пациента проявляются поражения почек в виде стремительно прогрессирующего гломерулонефрита. Симптомы — кровь в моче, повышенный белок, болезненность в области поясницы. При поражении органов ЖКТ не исключен стул с примесью крови или рвотные массы с кровью.
- ЭГПА. В этом случае ко всем приведенным выше симптомам примешивается эозинофильный мио- или эндокардит, перикардит, гипертензия артериальная. На коже проявляются подкожные узелки, папулы. Со временем из папул образуются язвы. Отмечаются боли в животе при поражении органов ЖКТ.
Важно: причинами летальных исходов при ААВ становятся острая почечная или сердечная недостаточность, остановка кровообращения, сильное внутреннее кровотечение, дыхательная недостаточность.
Диагностика заболевания
Для постановки точного диагноза следует сделать анализ крови на антинейтрофильные цитоплазматические антитела. В 50 % случаев у больного выявляют миелопероксидазу АНЦА, в 40 % случаев — протеиназу-3 АНЦА. И лишь в 10 % случаев результат является отрицательным.
Далее для подтверждения или опровержения диагноза нужно выполнить:
- общие анализы крови и мочи;
- КТ или МРТ пораженного органа;
- рентгеноконтрастное ангиологическое исследование;
- биопсию легких или почек (в зависимости от подозрений на орган-мишень).

Крайне важна дифференциальная диагностика, в ходе которой различают ГВ и синдром Черджа-Стросса (в первом случае астма отсутствует, во втором — присутствует). Также нужно исключить и другие патологии, при которых отмечается почечно-легочный синдром. В частности, это синдром Гудпасчера, васкулит системный, периартериит узелковый, васкулит геморрагический, красная волчанка системная, ангиоцентрическая злокачественная лимфома, образования злокачественные, сифилис и проказа, микоз, туберкулез, бериллиоз и др.
Важно: При ГВ в крови пациента выявляют антитела к протеиназе-3, в то время как при ЭГПА и при МПА у больного в крови повышена концентрация антител к миелопероксидазе.
Лечение патологии
Главной целью лечения системного васкулита АНЦА является достижение стойкой ремиссии. Поэтому терапию делят на три этапа:
- Индукция ремиссии. Здесь используют в основном глюкокортикоиды типа преднизолон и метилпреднизолон. Препараты вводят внутривенно методом капельниц и внутрь в виде таблеток. Как правило, улучшение наступает в течение первых трех недель лечения. Но расслабляться не стоит. Поддерживающая терапия показана каждые четыре недели.
- Поддержание ремиссии. На этом этапе продолжают введение циклофосфамида для поддержания стойкого результата. Также используют препараты метотрексат или азатиоприн. На сегодняшний день ученые изучают эффективность лефлуномида и микофенолата мофетила.
- Терапия эскалационная. Направлена на восстановление функций пострадавшего органа. Лечение подбирают в зависимости от сложности состояния пациента и внутреннего органа-мишени.
Общие прогнозы для пациентов с васкулитами АНЦА
В целом прогноз для пациентов с васкулитом АНЦА сложно назвать благоприятным. Но с усовершенствованием современной медицины показатели улучшаются. Жизненный прогноз для больных с ААВ зависит от формы развития болезни, своевременности поставленного диагноза и адекватности назначенного лечения. Кроме того во внимание стоит брать общее состояние организма пациента, его возраст и наличие дополнительных хронических заболеваний. Если говорить сухими цифрами, то прогноз для пациентов с ААВ выглядит так:
- Выживаемость при гранулематозе Вегенера в первый год от постановки диагноза составляет почти 85 %.
- В первые пять лет при ГВ выживаемость составляет около 65 %, при синдроме Черджа-Стросса около 65–70 %, при МПА — 46–54 %.
Важно: патология очень коварна и провоцирует летальность в первые 1–5 лет от момента выявления болезни.
Читайте также:


