Атрофия мышц у коров
Атрофия мышц
Атрофия мышц является следствием ряда заболеваний суставов, периферических нервов и спинного мозга (параличи), травм мышц, интоксикаций, злокачественных опухолей, авитаминоза Е и В, голодания и др.
В хирургической практике имеют значение следующие виды атрофии:
1) нейропатическая атрофия, возникающая вследствие первичного поражения крупных нервных стволов (жевательный, лицевой, предлопаточный, лучевой, бедренный и др.) или спинного мозга;
2) ишемическая атрофия на почве тромбоза крупных сосудов и их ветвей или сдавливание питающей артерии опухолью, экзостозом, рубцовой тканью и т. п.;
3) функциональная, или атрофия от бездеятельности, вследствие ограничения функции движения при многих заболеваниях (артриты,особенно остеоартриты, анкилозы суставов, остеомиелит, хроническое воспаление сухожилий и их влагалищ).
Разновидностью функциональной атрофии является травматическая атрофия, возникающая вследствие непосредственного повреждения мышц (ушибы, разрывы, сдавливания). Некоторые авторы атрофию при гнойных артритах относят к функциональной, что не вполне правильно, так как в ее возникновении большое значение имеют болевая реакция и патологические рефлексы с пораженной ткани.
Патогенез. Уменьшение размера и объема мышц в связи с нервнотрофическими расстройствами может привести к полному исчезновению мышечных клеток. При этом атрофическим явлениям подвергается паренхима, в то время как строма мышцы сохраняется или даже разрастается. Нейропатические дистрофии характеризуются истончением мышечных волокон, их ядра оказываются в пустотах, исчезает рисунок мышцы. Через 2-3 месяца в пораженных мышцах уже неразличимы белые и красные волокна. Одновременно происходят сложные биохимические изменения: снижение креатина, гликогена, фосфоркреатина и молочной кислоты. При гнойных артритах, особенно крупных суставов, атрофия мышц возникает рефлекторно. Раздражение синовиальной оболочки токсическими продуктами передается в спинномозговые центры, а оттуда по эффекторной дуге соответствующим мышцам, где начинает развиваться атрофический процесс.
В патогенезе ишемической атрофии важное значение имеет нарушение артериального кровоснабжения и уменьшение в связи с этим притока питательных веществ. Происходит уменьшение объема работающей мышцы, но дегенерация клеток обычно отсутствует. С восстановлением необходимого притока крови мышцы постепенно принимают нормальный вид. При недостатке в кормах токоферола (витамина Е) нарушается регулирующая роль нервной системы, что может сопровождаться атрофией мышц.
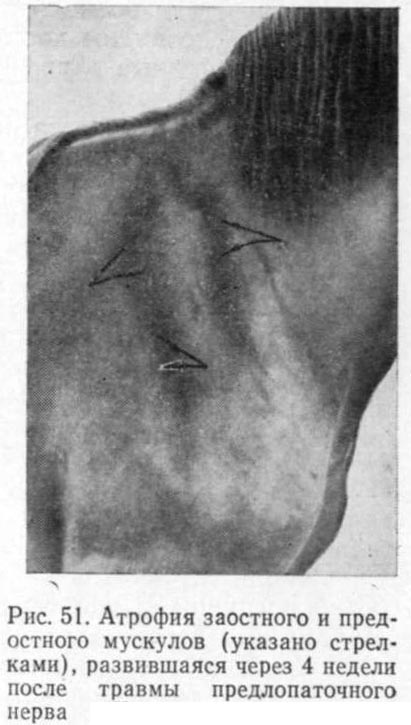
Клинические признаки. Атрофированные мышцы легко обнаруживаются при сравнении симметричных участков тела. Они уменьшены в объеме, плотнее, чем здоровые, отсутствует или слабо выражена защитная реакция при пальпации. На фоне атрофированных мышц ясно видны костные выступы. Особенно быстро развиваются нейрогенные атрофии на почве параличей двигательных нервов (рис. 51).
Атрофии, развившиеся вследствие хронического воспаления суставов, сухожильных влагалищ и костей, должны рассматриваться в связи с основным заболеванием. Это помогает правильно диагностировать патологический процесс и определить прогноз. Клиническим исследованием не всегда можно отличить функциональную атрофию от нейрогенной. В целях дифференциальной диагностики мышцу испытывают гальваническим током. Если реакция на ток отсутствует, это указывает на нейрогенную атрофию или на полное фиброзное перерождение мышц.
Лечение. При выборе методов лечения следует учитывать основное заболевание, так как воздействие только на пораженные мышцы не достигает цели, если не будет устранена причина (воспаление сустава, паралич нерва и т. п.). Важным способом восстановления функции мышцы является массаж в сочетании с активным и пассивным движениями, втиранием раздражающих мазей и линиментов. Показаны инъекции вератрика, стрихнина, витаминов группы Е (токоферол) и В (тиамин, пиридоксин, цианкобаламин). Хороший результат можно получить от ритмичной гальванизации мышц, предупреждающей атрофические явления. Ритмическую гальванизацию делают ежедневно или через день, в зависимости от реакции животного.
Беломышечная болезнь представляет собой патологический процесс, в результате которого происходит нарушение обменных реакций в животном организме. Больная особь не получает необходимое количество углеводов, минералов и белков.

У животного наблюдаются ярко выраженные мышечные патологии. В зоне риска находится сердечно-сосудистая система. Сердце не получает должного питания, вследствие чего у него начинается дистрофия мышц. По результатам вскрытия констатируют несоответствие размеров органа с возрастом телёнка.
Несвоевременная диагностика и лечение заболевания приводит к 70% гибели крупного рогатого скота в раннем возрасте. Болезнь проявляется в зимний или осенний период времени. В зоне риска находятся участки с торфяной и песчаной почвой.
Каковы особенности патологии
Беломышечная болезнь у молодняка проявляется у тех особей, самки которых не получали полноценного питания в период вынашивания плода. Однако опытные ветеринары утверждают, что спровоцировать подобные изменения в животном организме может недостаток селена, липидов и витаминов группы А в составе кормовых смесей.
Заболевание распространено на тех участках, где уровень серы в составе почвогрунта превышает допустимые пределы. В сезон дождей повышенная влага быстро растворяет этот микроэлемент, тем самым увеличивая впитываемость корневой системы растения. В результате кормовые травы насыщаются серой.
Еще одной причиной появления беломышечной болезни у молодых телят является несоблюдение правил условия содержания. В помещениях не осуществляется регулярная уборка и обработка кормушек антисептическими составами.
Повышенная влажность в закрытом пространстве приводит к размножению грибковой инфекции, которую регулярно вдыхают животные.
Существует еще одно мнение, которое заключается в том, что спровоцировать патологические изменения в организме теленка может недостаток витаминов группы Е.
В ветеринарной медицине выделяют ряд случаев, констатирующих беломышечную болезнь у других видов животных и птиц. Молодые ягнята, утки и гуси были подвержены подобным изменениям.
Спровоцировать подобную аномалию способен недостаток белка и повышенный уровень азота в составе кровяной массы. Заболевание нарушает обменные реакции с кератином.
У больных особей отмечают высокий уровень фосфора в крови. Подобная патология чаще всего констатируется в странах США и Австралии.
На территории России заболевание вступает в активную фазу в зимний период времени.
Сухая трава, в составе которой находится высокий уровень серы приводит к изменениям в организме коз и птиц. При употреблении такого корма в организме животного появляются серьезные аномалии. В результате чего они медленнее растут и набирают мышечную массу.

Симптоматика болезни
После гибели животного проводят патологоанатомическое исследование. При визуальном осмотре констатируют сильное истощение. Выявляют ряд симптомов, которые указывают на появление беломышечной болезни у телят. К ним относятся:
- Сильная отечность в области подкожной клетчатки.
- Симметричные изменения в районе скелетных мышц.
- Появление стертого рисунка в области мышечных волокон.
- Увеличенное или уменьшенное сердце.
- Появление гиперемии легких.
- Мягкая структура головного мозга.
В свою очередь, патологические процессы у молодых особей делятся на три стадии:
- Острая;
- Подострая;
- Хроническая.
У зараженных животных наблюдают следующие изменения:
- Угнетенное состояние. Теленок становится малоподвижным. В течение дня он находится в лежачем положении.
- У него появляется частое сердцебиение и тяжелое дыхание. Подобную патологию провоцирует нарушение со стороны сердечно-сосудистой деятельности.
- Фекалии теленка приобретают резкий и зловонный запах.
- В период употребления пищи у животного появляется сильное слюнотечение, вздутая брюшная полость, скрежет зубов.
- Повышенная температура тела.
- Судороги.

Острая беломышечная болезнь
Острая форма патологии быстро проявляется. Первоначальные признаки наблюдаются уже на 7 день с момента поражения.
Больная особь слишком слабая и ощущает большой упадок сил. Телёнок предпочитает находиться в лежачем положении в течение всего дня. У него констатируют мышечную дрожь и паралич задних конечностей. В результате нарушается походка и скорость передвижения.
Дыхательная функция приводит к появлению тахикардии. Дыхание становится затрудненным и слишком частым. Подобные аномалии проявляются среди желудочно-кишечного тракта. Больное животное имеет вздутый кишечник, гнойные выделения из глаз и носовых проходов.
Подострая стадия патологии
Данная разновидность сопровождается менее выраженными признаками. Они проявляются через 15-30 дней. Эта форма беломышечной болезни требует правильного лечения.
Отсутствие каких-либо мероприятий по улучшению состояния животного провоцирует летальный исход в течение месяца после проявления первоначальных признаков.
Важно! Больной теленок начинает хрипеть при каждом вдохе. У него резко снижается аппетит, появляется пневмония.

Хроническая стадия
Хроническая форма болезни проявляется у молодых особей, возраст которых не превышает 3,5 месяца. Спровоцировать подобную стадию может отсутствие правильного лечения и обнаружение первоначальных симптомов.
Клиническая картина болезни имеет некоторое сходство с другими стадиями патологического процесса. Отличительной особенностью данной формы является медленное истощение животного организма и его малоподвижность в течение дня.
Диагностика
Выявить аномальные отклонения в раннем возрасте можно при помощи специальных анализов. Отличительной особенностью беломышечной болезни у телят является ее способность проявляться через некоторое время.
Например, если в стаде появился больной телёнок, то, скорее всего, другие особи будут подвержены этой болезни, если никак не реагировать на основной источник заражения.
Ветеринары в течение нескольких лет собирают полный анамнез болезни и скорость ее проявления среди всех особей крупного рогатого скота. Для подробного исследования проводят электрокардиографию, рентгеноскопию и рентгенографию.
Подобные методики диагностики позволяют своевременно обнаружить изменения в состоянии мышечных тканей и костной массе. По результатам диагностики опытный ветеринар подбирает соответствующее лечение и дальнейшие профилактические действия.

Лечение болезни
Опытные специалисты утверждают, что нет специального лечения для беломышечной болезни у молодых телят.
Для облегчения общего самочувствия и сокращения уровня серы в составе травяной массы используют препараты на основе селена, тривитаминов и специальных аминокислот. Белковые гидролизаты сокращают появление первоначальных симптомов патологического процесса.
Лечебная терапия предусматривает проведение комплексных манипуляций. Больного теленка изолируют от общего стада на момент реабилитации. Улучшают условия его содержания, нормализуют рацион питания. Количество активных веществ и дозировку препарата должен рассчитывать опытный специалист.
Важно! Если заболеванию подверглась беременная корова, то для ее лечения применяют инъекции на основе селенида натрия и токоферола. Эти вещества при взаимодействии друг с другом оказывают мощный лечебный эффект.
За беременными особями необходимо тщательно следить. В зависимости от общего самочувствия, животному могут проводить ультразвуковые исследования и скрининг-тесты для своевременного выявления патологических изменений внутри плода.
Помимо этого, применяют эффективное средство на основе натрия. Для самки, вынашивающей плод, используют дозировку из расчета 0,3 мл на 1 кг живого веса. Это вещество быстро нормализует обменные реакции внутри животного организма и понижает уровень серы. Это вещество восполняет недостаток белка, углеводов и аминокислот в составе травяной массы.
Основные правила терапии:
- Для лечения сердечных патологий у телят и молодых ягнят используют камфору и кофеин.
- Животные находятся на выгуле более 5 часов в сутки.
- Помещение, где находились заражённые особи, тщательно обрабатывают антисептиками и ультрафиолетовыми лампами. Подобная манипуляция позволяет уничтожить вирусные и бактериальные организмы, которые негативно сказываются на состоянии теленка. Особое внимание необходимо уделить вентиляции внутри пространства, а также состоянию подстилки.
Мокрая трава и влажные стены могут спровоцировать разрастание грибков. Они выделяют в воздушные массы споры опасных микроорганизмов, которые при попадании внутрь организма провоцируют появление пневмонии.

Правила профилактики
Профилактические меры для предотвращения появления беломышечной болезни у телят включают в себя добавление комплексных составов на основе натрия, белка и меланина. Эти вещества отвечают за состояние мышечных волокон и укрепляют сердечно-сосудистую систему.
При появлении первоначальных признаков заболевания у молодых особей не рекомендуется заниматься самолечением. Отсутствие специальной терапии и лекарственных препаратов в первые дни могут нанести существенный вред молодому организму.
Определение атрофии
Уменьшение объеме органа, ткани или отдельных клеток с одновременным снижением или угасанием их функции вследствие недостаточного питания и снижения интенсивности обмена веществ. В отличие от атрофии орган может не достигать полного развития - гипоплазия , иметь вид раннего зачатка (аплазия) или полностью отсутствовать - агенезия.
Этиология и классификация. Атрофия бывает физиологической и патологической, местной и общей. Атрофия как физиологический процесс развивается в течение всей жизни организма в связи с онтогенетическими закономерностями и функциональными изменениями в отдельных органах и в организме в целом.
Физиологическую атрофию подразделяют на эволюционную и инволюционную, или старческую. С завершением роста организма почти полностью атрофируется тимус, а у птиц и фабрициева сумка, с замещением железистой ткани жировой клетчаткой. У самок млекопитающих происходит периодическая атрофия и гипертрофия матки и молочных желез в зависимости от физиологического состояния: покоя, беременности и лактации. Инволюционная, или старческая, атрофия нарастает по мере старения и изнашивания организма в связи с постепенным снижением интенсивности метаболических процессов и синтеза белков, уменьшением клеток в тканях и органах. У старых лошадей развивается физиологическая атрофия правой доли печени вследствие постоянного давления на нее ободочной кишки.
Патологическая атрофия наблюдается в любом возрасте в результате воздействия каких-либо чрезввычайвредных факторов. Непосредственные причины ее - недостаточное питание, интоксикация, расстройства крово- и лимфообращения, нарушения гуморальной регуляции обменных процессов в организме или иннервации органа. Патологическая атрофия может иметь общий характер, когда атрофии подвергаются одновременно многие органы и ткани, или же быть местным процессом, связанным с атрофией отдельных органов.
Общая атрофия, или истощение, может быть алиментарной (атрофия от голодания) или следствием других заболеваний: хронических инфекций (туберкулез, бруцеллез и др.), болезней органов пищеварения (хронический гастрит, энтерит, циррозы печени), кроветворных органов и крови (анемии, лейкозы), злокачественных опухолей, нарушений деятельности эндокринных органов, нервной системы, раневого или травматического истощения. Истощение в тяжелой степени с прогрессирующей интоксикацией называется кахексией, или маразмом. При атрофии общего характера в процессе вовлекаются многие органы и ткани. При этом, в первую очередь, исчезает жир из жировых депо. В последнюю - жир из подэпикардиальной жировой клетчатки. Затем уменьшается мышечная ткань, паренхиматозные органы и, в последнюю очередь, ЦНС. Жировая клетчатка при атрофии приобретает отечный студневидный вид - серозная атрофия жировой клетчатки.
Местная атрофия разнообразна по происхождению и видам. В зависимости от причин различают атрофии: дисфункциональную, дисциркуляторную (ангиогенную); от давления; дисгормональную; нейротическую; под воздействием физических и химических факторов.
Дисфункциональная атрофия развивается в результате снижения или полного выпадения функций органа или ткани (атрофия от бездействия). Этот процесс развивается в мышцах при переломе костей, патологии суставов и конечностей с ограниченной подвижностью. В недостаточно функционирующих органах снижаются кровоток, поступление кислорода и питательных веществ, падает интенсивность обмена веществ и восстановительных процессов, развивается их атрофия.
Дисциркуляпюрная атрофия, или атрофия от недостаточности кровоснабжения, связана с расстройством местного кровообращения в органе вследствие сужения просвета артериального сосуда, внешнего сдавливания его или утолщения стенки (артериосклероз). Например, из-за гипоксии и нарушения питания при склерозе сосудов головного мозга, миокарда, почек или других органов развивается их атрофия.
Атрофия от давления развивается в связи с длительным механическим давлением на органы и ткани патологических образований. При сдавливании органов и прежде всего сосудов нарушаются кровообращение, дыхание и питание тканей. Атрофия от давления часто возникает в железистых паренхиматозных органах при затруднении оттока (застой) крови, секрета или экскрета, при давлении на сосуды и выводные протоки скопившейся крови, растущей опухоли, закупорки их конкрементами, гельминтами, воспалительным экссудатом. Например, прогрессирующая атрофия от давления возникает в почках при нарушении проходимости мочеточника. Скопление мочи в почечной лоханке и в собирательных канальцах приводит к атрофии мозгового, а затем и коркового слоя с развитием водянки почек, или гидронефроза. В железистых органах при хроническом воспалении атрофии подвергается сдавленная секретом эпителиальная ткань фолликулов с образованием застойных или ретенционных кист. Длительная сердечно-сосудистая недостаточность или местные расстройства кровообращения вызывают хроническую застойную гиперемию во многих или отдельных органах с развитием их атрофии.
Например, атрофия печеночных клеток и балок происходит от сдавливания их синусоидными капиллярами, переполненными кровью. Крупные аневризмы (местное расширение артерий) и новообразования вызывают атрофию не только мягких тканей, но и костей.
Дисгормональная атрофия связана с нарушением функции желез внутренней секреции. При функциональной недостаточности или гипофункции гипофиза, щитовидной железы или яичников уменьшаются размеры матки и молочной железы; кастрация самцов сопровождается атрофией предстательной железы; некоторые гормональные препараты также вызывают атрофические изменения в эндокринных железах. Продолжительное применение инсулина приводит к атрофии панкреатических островков, а АКТГ и кортикостероидов - к атрофии коры надпочечников (надпочечниковой недостаточности). Под влиянием избыточного йода наступает атрофия щитовидной железы.
Неврогенная атрофия возникает при нарушении трофической функции нервной системы и иннервации органов. Это происходит при разрушении нервных волокон и повреждении нервных клеток, вызываемом травмой, воспалением, кровоизлиянием, опухолью. Этот вид атрофии чаще всего встречается в каких-либо скелетных мышцах, костной ткани и в коже при гибели соответствующих моторных нейронов вентральных рогов спинного мозга или нервных проводников с развитием их пареза или паралича.
Атрофии, связанные с действием некоторых физических факторов и химических веществ. К физическим факторам относят лучевую энергию, вызывающую ионизацию в тканях. При этом атрофические изменения в первую очередь развиваются в органах кроветворения и размножения. Проникающая радиация вызывает атрофию и некроз клеток костного мозга, лимфатических узлов, селезенки и половых желез.
К химическим факторам, вызывающим атрофические процессы в органах и тканях, принадлежат химические ядовитые вещества, бактериальные и грибковые токсины (токсическая атрофия). Хроническое воздействие их на клетки и ткани сопровождается развитием не только дистрофических, но и атрофических изменений (дистрофическая атрофия).
Патогенез. При атрофии он сложен и зависит от причины и вида атрофии. Сущность атрофии определяется не только недостаточным поступлением к органам и тканям кислорода (гипоксия) и питательных веществ, но и неспособностью клеток ассимилировать их вследствие гипокинезии и структурно-функциональных нарушений. Механизм развития любой атрофии связан со снижением уровня и интенсивности обмена веществ в клетках и тканях, с преобладанием в них диссимиляции (катаболических процессов) над ассимиляцией (анаболическими процессами). Это приводит к постепенным преимущественно количественным, в меньшей мере качественным изменениям физико-химического состава, ультраструктурной организации клеток и тканей, к уменьшению количества органелл и в целом массы органа.
Атрофический процесс в организме протекает неравномерно, что связано с особенностями функционирования различных органов и тканей, характером распределения питательных веществ в них и видом алиментарной недостаточности. При недостаточном поступлении питательных веществ (голодании) или нарушении их усвоения (истощение при инфекционной, раковой, гипофизарной, церебральной кахексии и других болезнях), несмотря на общий характер нарушения питания, атрофии в первую очередь подвергаются жировая клетчатка, скелетные мышцы, кожа, затем - внутренние органы и лимфоидная ткань. Позднее всего атрофические изменения наступают в сердечной мышце и головном мозге. При атрофии отдельных органов атрофические изменения начинаются с органелл цитоплазмы паренхимных клеток и в последнюю очередь распространяются на ядро. Уменьшается объем отдельных клеток, тканевых образований и органа в целом. Если атрофические изменения органа затрагивают генетический аппарат клетки (а это наступает в последнюю очередь), то клетка, теряя способность к восстановлению, увядает и разрушается.
В биохимическом отношении атрофия носит черты медленно прогрессирующего аутолиза, причем всасывание продуктов последнего не сопровождается какими-либо реактивными явлениями в противоположность некротическим процессам.
Микроскопические изменения органов и тканей при атрофии. Они проявляются уменьшением величины преимущественно паренхиматозных клеток, уплотнением (дегидратацией) цитоплазмы и в меньшей мере ядерных структур (простая атрофия). В атрофирующихся клетках возрастает ядерно-цитоплазматическое отношение, исчезают продукты секреции и запасные питательные вещества (гликоген и др.), в условиях дефицита кислорода накапливаются в повышенном количестве продукты неполного сгорания, аутооксидации и пероксидации, в частности сложный глико-липопротеид, или липофусцин. Этот пигмент светооптически выявляется в виде зерен золотистого или коричневого цвета в цитоплазме клеток вблизи ядер, а электронно-микроскопически имеет вид электронно-плотных гранул, окруженных трехконтурной мембраной. Особенно много его обнаруживается в печени, в волокнах скелетных мышц, в клетках центральной и вегетативной нервной системы, где он встречается и в норме, а с возрастом накапливается. При электронно-микроскопическом исследовании атрофирующихся клеток обращают на себя внимание сохранность ядра и основных органелл цитоплазмы с более тесным расположением в клетке, уменьшением размеров и количества их, особенно митохондрий и гранулярной цитоплазматической сети, содержащей относительно небольшое количество рибосом, что свидетельствует о снижении синтеза белков. Как правило, отсутствуют какие-либо признаки пролиферации со стороны ультраструктур. Однако регенеративная реакция при атрофии все-таки может наблюдаться в виде амитотического размножения ядер в атрофирующейся скелетной мышце, иногда в печени, почках и других органах; отмечают разрастание соединительнотканных и жировых клеток с вакатным замещением атрофированных паренхиматозных элементов органа. Но при дальнейшем нарастании атрофического процесса строма вместе с сосудами также атрофируется.
По мере нарастания атрофических изменений в процесс все более вовлекаются ядра клеток; они уменьшаются в объеме, уплотняются, отмечают скопление хроматина у ядерной мембраны (маргинальный гиперхроматоз), уменьшение величины ядрышек и в конечном счете распад нуклеопротеидов под действием внутриклеточных нуклеаз. В этих случаях уменьшается не только объем клеток, но и их число (нумеративная атрофия). Паренхиматозные клетки жировой ткани при атрофии сморщиваются. Межклеточное вещество уплотняется, подвергается деструкции, или в нем скапливается серозная жидкость. Атрофирующиеся клетки окрашиваются более интенсивно гистологическими красителями. Коллагеновые и эластические волокна деформируются и приобретают базофильные свойства.
Макрокартина атрофии.
При атрофии они характеризуются в большинстве случаев уменьшением объема и массы органа с сохранением его рисунка и внешней формы. Поверхность органа при этом гладкая (гладкая атрофия), реже орган (например, печень, почки) принимают зернистый или бугристый вид (зернистая атрофия) в связи с неравномерным развитием атрофических изменений, компенсаторным разростом соединительной ткани и последующим ее уплотнением. В результате атрофии преимущественно паренхимы органа и сохранения стромы соединительнотканная капсула такого органа сморщена или утолщена, края некоторых органов (например, печени, селезенки) имеют кожистый или острый вид, кровенаполнение атрофированного органа снижается, окраска его бледнее, при накоплении пигмента липофусцина орган приобретает бурый цвет (бурая атрофия). Консистенция органа более плотная, чем в норме.
Некоторые органы (сердце, легкие, почки и др.), имеющие преформированные или патологически образованные полости, при атрофии их паренхимы или стенки могут быть увеличены в объеме за счет расширения и скопления в полостях крови (ложная гипертрофия сердца), воздушной массы (альвеолярная или интерстициальная эмфизема легких), жидкости (гидронефроз, киста яичника и других железистых органов), кормовых масс или газов (желудок и кишечник). Такую атрофию полостных органов с истончением стенок и увеличением просветов (эксцентрическая атрофия, или ложная гипертрофия) следует отличать от острого расширения сердца, желудка или кишечника другого генеза. Увеличение органа при атрофии его паренхимы может быть связано с разрастанием в нем или вокруг него соединительной ткани или жировой клетчатки (вакатное разрастание жира).
Если при атрофии паренхимы полостного органа с одновременным истончением стенки уменьшается и полость органа, то орган в целом уменьшается в объеме (концентрическая атрофия).
При алиментарной и других видах общей атрофии наиболее выраженные макроскопические изменения отмечают со стороны жировой клетчатки, скелетных мышц, костей (остеопороз) и паренхиматозных органов, размеры которых существенно уменьшаются, а жировая ткань почти полностью исчезает. У старых животных атрофичная жировая клетчатка приобретает охряно-желтый цвет в связи с накоплением пигмента - липохрома (старческая атрофия). Кожа становится серо-коричневой окраски из-за усиленного образования меланина, паренхиматозные органы (печень, скелетные мышцы и др.) имеют буровато-коричневый цвет в связи с накоплением в них липофусцина (бурая атрофия органов). Кроме того, при тяжелых формах истощения жировая ткань эпикарда, подкожная и межмышечная клетчатка, жировой костный мозг пропитываются серозной жидкостью, становятся отечными, студневидными (серозная атрофия соединительной ткани).
Исход атрофии.
При своевременном устранении причины – возврат органа к первоначальному состоянию. При далеко зашедших процессах – некроз клеток с последующим разростом соединительной ткани.
Функциональное значение атрофии. Для организма оно зависит от степени структурных изменений органа и понижения его функций. Атрофия - обратимый процесс, т. е. атрофированные органы и ткани восстанавливают свою структуру и функции, если устраняются причины, ее вызвавшие, а сами атрофические изменения не достигли еще высокой степени. Восстановление атрофированных тканей может быть полным или неполным (с частичным сохранением органа и его функций). Атрофические изменения, вызывающие значительное уменьшение величины клеток, тяжелые повреждения их генетического аппарата, носят необратимый храктер.
Эта болезнь характеризуется резким повышением тонуса сухожильно-мышечных рефлексов тазовых конечностей и некоторым отведением конечности кзади вследствие гипертонуса икроножного мускула и пяточного сухожилия.
Механизм возникновения болезни еще не выяснен, однако полагают, что повышение сухожильно-мышечного тонуса обусловлено дегенерацией бледных ядер, расположенных в полосатом теле, и красных ядер.
Спастический парез наблюдали во многих странах. В ГДР болезнь описывается как проявление рецессивных врожденных явлений, имеющих место в тех географических зонах, где скрещивали черно-пестрых коров остфризов с тучными, жирными быками.
По данным Ф. Гутира и И. Марека, спастический парез задних конечностей широко распространен среди телят красной датской молочной породы.
О. Дитц (1961) наблюдал эту болезнь в ГДР, причем этиологически ее связывают с недостатком в организме микроэлементов, особенно марганца. Е. Виснер (1965) относит спастический парез к врожденным болезням и полагает, что генез связан с рецессивным наследственным предрасположением. Болезнь проявляется у гомозиготных особей, в то время как у гетерозиготных внешне она ничем не проявляется; животные выглядят здоровыми.
Исследования показали, что при несбалансированном и однообразном кормлении стельных коров наблюдается белковая, минеральная и витаминная недостаточность. Отмечены признаки повышения болевой чувствительности суставов, деформация рога, атония и гипотония преджелудков. От таких коров рождаются слабые, недоразвитые телята, подверженные заболеваниям (М. П. Терехила, З. И. Бобылева, И. И. Ситко, В. М. Подкопаев, В. П. Шишков и др.).
В связи с этим можно предполагать, что изменение нервной проводимости и, как следствие, нарушение чувствительности вызывает спастические парезы и дрожание определенных групп мышц (дрожательный паралич). Исследования Э. и Н. Кристенсенов (1952) показали, что повышение тонуса сухожильно-мышечных рефлексов происходит в результате дегенеративных изменений в бледном ядре, расположенном в полосатом теле. Нужно отметить, что у млекопитающих эти ядра служат важнейшими подкорковыми двигательными центрами, координирующими непроизвольные движения (бег, лазание, ходьба и т. д.) и мышечный тонус в состоянии физиологического покоя. Поэтому данные этих авторов в известной мере объясняют механизм спастического пареза задних конечностей и дрожательные парезы мускулов.
Полосатые тела функционируют как единое целое, но отдельные их части действуют с противоположным эффектом. Так, бледное тело вместе с медиальным ядром зрительного бугра усиливает движения, a corpus striatum, напротив, их тормозит.
М. Хомяк и З. Милярт (1957) наблюдали спастический парез у быка и установили патоморфологическую природу болезни. Нервную этиологию пареза авторы подтвердили тем, что после инъекции 60 мл 2,5%-ного раствора новокаина субдурально на уровне 1—2-го хвостовых позвонков у быка удалось получить резкое расслабление мышц тазовых конечностей, которые до этого находились в состоянии окоченелости, вызванной спастическим сокращением. Патоморфологические изменения обнаружены в гигантских клетках шва продолговатого мозга, которые у крупного рогатого скота составляют 2/3 задней части этого органа (М. Хомяк). Изменения выражались в наличии вакуолей в плазме этих клеток в гидролизе протоплазмы. Количество измененных клеток составило 5,34%. Более интенсивные изменения типа дегенерации обнаружены в красном ядре левой стороны, что соответствовало клинической картине наибольшей выраженности симптомов пареза правой конечности.
Клиническая картина. Болезнь характеризуется парезами, наблюдающимися у новорожденных телят в первые педели и месяцы жизни (ранний парез) и у животных в возрасте от 2 до 5 лет (поздний парез).
Типичным симптомом является укорочение конечности вследствие сильного натяжения пяточного сухожилия и икроножного мускула. Скакательный сустав разогнут, а конечность несколько оттянута кзади, поэтому копыто приподнято и зацепной стенкой касается почвы. Иногда конечность настолько оттянута кзади, что плюсневая кость ложится на противоположную плюсну, перекрещиваясь с ней. Хотя этот признак непостоянен, но он характерен для раннего пареза и должен учитываться при дифференциальном диагнозе.
В ранней стадии болезни копыто касается почвы, так как гипертонус икроножной мышцы еще не так сильно выражен. В поздней стадии зацепная стенка копыта может не касаться почвы. В этом случае животное подолгу лежит, а если встает, то можно видеть продолжительную судорогу мышц. Наблюдается общая дрожь, спутанная семенящая походка и затруднение в удерживании равновесия тела. Животное лежит с вытянутыми задними конечностями.
Больные телята плохо развиты, но особенно характерно то, что можно сравнительно быстро обнаружить гипотрофию мускулатуры тазовых конечностей.
Диагноз ставят с учетом анамнеза и симптомов болезни. Необходимо исключать судороги, появляющиеся в результате отравления животного и после вставания. Такие судорожные явления чаще наблюдаются у взрослых и старых коров. В отличие от тетании судороги носят клонико-топический характер и никогда не появляются у животного, находящегося в лежачем положении.
Клонические судороги у животных возникают вследствие раздражения периферических нервов или центральной нервной системы. Они характеризуются непроизвольными периодическими, довольно частыми сокращениями отдельных мышц или мышечных групп, быстро сменяющихся расслаблениями. Эти судороги возникают в одних и тех же мышцах и не распространяются на другие мышцы.
Тонические судороги — длительные нарастающие сокращения мышцы, как бы застывающей в этом состоянии. Судорога мышц конечностей (крамп), жевательных мышц (тризм) и т. д.
Кроме того, у телят известны так называемые дрожательные судороги. Их предвестником является спутанная, семенящая походка. Затем мускулатура плечевого пояса начинает фибриллярно подергиваться и происходит дрожание мышц, наблюдающееся и в лежачем положении животного. Если же теленка поставить на ноги, то дрожание становится более заметным. Эта болезнь была впервые установлена в предгорье Альп. После дачи уротропина симптомы болезни быстро исчезают (одна столовая ложка 15%-ного раствора уротропина 3 раза в день с молоком).
Лечение. Специфических методов лечения и профилактики нет. Не рекомендуется использовать для племенных целей больных животных, так как возможна передача болезни потомству. Коровы, переболевшие спастическим парезом, сохраняют молочную продуктивность, поэтому проведение симптоматической терапии заслуживает внимания.
Из паллиативных мер для устранения тугоподвижности конечности молено рекомендовать частичную тенотомию поверхностного сгибателя пальца и ахиллова сухожилия, улучшающую, двигательную функцию (Getze, 1932; Кофман, 1941).
Мы наблюдали двух телят с выраженной симптоматологией спастического пареза тазовых конечностей. У первого теленка в 3-месячном возрасте была поражена заднебедренная группа мышц левой конечности. После местного лечения (облучение лампой соллюкс, массаж, инъекции вератрина) животное быстро выздоровело.
У второго теленка (возраст 4,5 месяца) наблюдалось двустороннее поражение в сильной степени (атрофия мускулов). Внутримышечные инъекции вератрина в спирте, витамина В12, физиотерапия, массаж не дали положительного результата.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:


