Агрессивный фиброматоз мягких тканей у детей
Агрессивный фиброматоз у детей
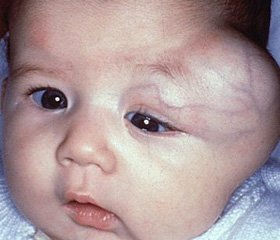
В клинике детской хирургии с 1985 по 2011 годы лечилось 17 детей с агрессивным фиброматозом в возрасте от 11 месяцев до 16 лет. Опухоли экстраабдоминальной локализации выявлены у 12 (70,6%) больных, интраабдоминальной – у 5 (29,4%). Лечение агрессивного фиброматоза хирургическое. Опухоль склонна к постоянному рецидивированию. По нашим данным, рецидивы при экстраабдоминальной локализации опухоли отмечены у 33,3% больных. При интраабдоминальном расположении очага агрессивного фиброматоза радикальная операция выполнена у 40% пациентов. После повторной операции по поводу рецидива опухоли необходимо проводить полихимиотерапию и лучевую терапию. Больные с агрессивным фиброматозом должны находиться на диспансерном учете. Контрольное ультразвуковое исследование необходимо проводить ежемесячно.
У клініці дитячої хірургії з 1985 по 2011 роки лікувалося 17 дітей з агресивним фіброматозом у віці від 11 місяців до 16 років. Пухлини екстраабдомінальної локалізації виявлені у 12 хворих (70,6%), інтраабдомінальної – у 5 дітей (29,4%). Лікування агресивного фіброматоза хірургічне. Пухлина схильна до постійного рецидивування. За нашим даними, рецидиви за екстраабдомінальною локалізацією пухлини відзначені у 33,3% хворих. За інтраабдомінальному розташуванню осередку агресивного фіброматоза радикальна операція виконана у 40% пацієнтів. Після повторної операції із приводу рецидиву пухлини необхідно проводити поліхіміотерапію та променеву терапію. Хворі з агресивним фіброматозом повинні перебувати на диспансерному обліку. Контрольне ультразвукове дослідження необхідно проводити щомісяця.
In the clinic of Pediatric Surgery from 1985 to 2011 the 17 children with aggressive fibromatosis were cured. The age of children was from 11 months to 16 years. The extraabdominal localization of the tumor were found in 12 patients (70,6%), the intraabdominal localization of the tumor were detected in 5 patients (29,4%). The treatment of aggressive fibromatosis was surgery. The tumor may recur constantly. According to our data, the recurrence of the extraabdominal tumor were observed in 33,3% of patients. When the source of aggressive fibromatosis has the intraabdominal location, the radical surgery was performed in 40% of patients. The polychemotherapy and radiotherapy should be carried out after the second operation for recurrent tumor. The patients with aggressive fibromatosis should be on the dispensary. The control ultrasound should be carried out monthly.
агрессивный фиброматоз, дети
агресивний фіброматоз, діти
aggressive fibromatosis, children
Агрессивный фиброматоз (АФ) – сборная группа новообразований фибробластического и миобластического ряда, которые возникают из сухожилий и фасциально-апоневротических структур, а источником опухолевого роста является фиброцит [1, 8]. В клинической практике, наряду с термином агрессивный фиброматоз, в равной мере употребляется термин десмоид. Реже встречаются следующие синонимы: десмоидная фиброма, глубокий фиброматоз, десмома, инвазивная фиброма, неметастазирующая фибросаркома, мышечно-апоневротический фиброматоз [2, 3, 7].
Клинические проявления АФ определяются локализацией и размерами опухоли. Выделяют абдоминальную и экстраабдоминальную локализацию образований. Этиология АФ не установлена. В возникновении этого заболевания могут играть роль генетические и эндокринные факторы, а также механическая травма [1, 5, 8, 9, 12].
В связи с изложенным, в последние годы для лечения больных с АФ, наряду с оперативным вмешательством, стали шире использовать химиотерапевтические препараты и лучевую терапию. Ряд исследователей отмечает обнадеживающие результаты такого лечения [2, 4, 6, 7].
АФ может развиваться во всех областях человеческого тела, где представлена соединительная ткань. При локализации в конечностях, опухоли, как правило, возникают исключительно на сгибательных поверхностях (передние отделы плеча и предплечья, задние поверхности голени, бедра, ягодичная область). Источником роста опухоли всегда бывают ткани, расположенные глубоко относительно поверхностной фасции [6, 7].
Темпы роста образования обычно медленные, при этом рецидивы новообразования развиваются более бурно, чаще всего в течение нескольких месяцев. Клинически АФ выглядит как плотная, малосмещаемая (реже – несмещаемая) опухоль, расположенная в толще мышечного массива, слегка болезненная при пальпации, размеры ее колеблются от 3-5 до 10-12 сантиметров. В ряде случаев отмечается связь опухоли с надкостницей подлежащих костей.
Цель работы – оценить эффективность комплексного лечения агрессивного фиброматоза у детей.
Материал и методы
В клинике детской хирургии Донецкого национального медицинского университета за последние 26 лет лечилось 17 детей с АФ в возрасте от 11 месяцев до 16 лет. Лиц женского пола было – 9, мужского – 8. Опухоли экстраабдоминальной локализации выявлены у 12 (70,6%) больных, интраабдоминальной – у 5 (29,4%). Для подтверждения диагноза использовали ультразвуковое исследование (УЗИ), компьютерную томографию (КТ), магнитно-резонансную томографию.
Результаты и обсуждение
Среди наблюдаемых нами больных с экстраабдоминальной локализацией опухоль располагалась в самых различных местах: ягодичная область (2), предплечье (2), шея (2), лопаточная область (2), плечо (2), по одному пациенту на голени и подмышечной области с переходом на грудную стенку. Давность заболевания у наблюдаемых больных варьировала от нескольких недель (11 детей) до нескольких месяцев (6 пациентов). Приводим одно из наших наблюдений.
Больной Л., 1 года (история болезни № 13838), поступил в клинику детской хирургии 28.11.2011 г. с жалобами родителей на наличие у ребенка опухолевидного образования в области шеи справа. Болеет с 2-месячного возраста, когда было впервые обнаружено опухолевидное образование до 1 см в диаметре, осмотрен детским хирургом, заподозрена боковая (дермоидная?) киста шеи, рекомендовано наблюдение. Состояние оставалось удовлетворительным, однако опухолевидное образование увеличилось в размерах. С подозрением на тератому, агрессивный фиброматоз госпитализирован в клинику. Общее состояние при поступлении средней тяжести, самочувствие – удовлетворительное. Со стороны внутренних органов без особенностей. Место болезни: в области боковой поверхности шеи, справа, от угла нижней челюсти до яремной ямки, на уровне кивательной мышцы определяется опухолевидное образование, размерами 8´5 см, плотной консистенции, бугристое, не спаянное с кожей, ограничено подвижное, безболезненное. Был обследован, со стороны клинических и биохимических анализов изменений не выявлено. Мультисрезовая КТ (15.11.2011 г.): справа в мягких тканях шеи определяется дополнительное образование овальной формы с ровными, достаточно четкими контурами, размерами 8´6´5 см, по периферии которого в артериальную фазу визуализируется питающие его сосуды. Нижний край образования определяется парастернально (рукоятка грудины). Дифференцировать кивательную мышцу не представляется возможным. Верхний конец образования визуализируется на уровне угла нижней челюсти, книзу от края околоушной слюнной железы. Образование вплотную прилежит к яремной вене, сдавливает её, смещает кзади, также прилежит и деформирует общую сонную, частично наружную и внутреннюю сонные артерии (на протяжении до 1,5 см), смещает их медиально, просвет не суживает. Наружные контуры между образованием и прилегающими к нему сосудами местами четко не прослеживаются, однако, не смотря на деформацию сосудов и сдавление яремной вены, внутренние контуры всех сосудов – ровные, четкие, просвет их выполнен контрастным веществом. Просвет трахеи не сужен, на уровне образования несколько смещен влево. В остальном без патологии (со стороны грудной клетки, брюшной полости). Клинический диагноз: опухоль боковой поверхности шеи справа (тератома?, агрессивный фиброматоз?). 29.11.2012 г. ребенок оперирован.
После обработки операционного поля в косом направлении произведен разрез кожи длиной до 9 см над опухолевым конгломератом. Гемостаз. На всем протяжении рассечена m. platysma. Начато поэтапное выделение опухоли, которая представлена одиночным крупным узлом плотной ткани желтоватого цвета. Постепенно, с соблюдением принципов гемостаза, опухоль полностью выделена из окружающих тканей вплоть до внутренней яремной вены, последняя располагалась вдоль основания опухолевидного образования. Лигированы и пересечены два артерио-венозных пучка, питавших опухолевый узел. Опухоль удалена без нарушения целостности капсулы. Дополнительно удалены 2 лимфатических узла размерами 1´0,8´0,5 см, предлежавших к опухоли. Контроль на гемостаз – кровотечения нет. Послойное ушивание операционной раны наглухо. Интрадермальный шов на кожу. Туалет раны. Асептическая повязка.
Диагноз: рабдомиома (?), агрессивный фиброматоз (?) боковой поверхности шеи справа. Послеоперационный период протекал гладко. Рана зажила первичным натяжением, швы сняты. Заключение патогистологического исследования (№ 11742-63): АФ, в лимфоузлах – гиперплазия лимфоидной фолликулов, гистиоцитоз синусов. 12.12.2011 г. ребенок выписан домой в удовлетворительном состоянии. Был осмотрен через 2 месяца. Жалоб у родителей нет. Клинических и сонографических данных за рецидив опухоли нет.
При локализации АФ в ягодичной области и мягких тканях задней поверхности бедра, серьезную проблему представляет взаимоотношение опухоли к седалищному нерву, который может быть частично или полностью вовлечен в опухолевый процесс. Удаление такой опухоли сопряжено с риском послеоперационного монопареза конечности и возможной нерадикальностью, вследствие технической сложности полного освобождения седалищного нерва от опухоли. В такой ситуации приходится рассчитывать на химиолучевую терапию. В подтверждении сказанного, приводим наше наблюдение.
Ребенок В., 5 лет (история болезни № 9349), поступил в клинику детской хирургии 12.08.2010 г. с жалобами на увеличение в объеме правой ягодицы. Болеет в течение 3-4 недель, когда выявили увеличение ягодицы. Осмотрен хирургом, направлен в клинику. Состояние при поступлении удовлетворительное. Активен, не лихорадит. Со стороны легких и сердца без особенностей. Живот мягкий, безболезненный. Со стороны клинико-лабораторных анализов без особенностей. Место болезни: правая ягодица увеличена в объеме, напряжена. В толще мышечного массива определяется плотная опухоль до 5,0 см в диаметре. В клинике был обследован. УЗИ: в правой ягодичной области лоцируется бугристое образование, размерами 63´40 мм. При ЦДК прослеживается кровоток. Образование исходит, вероятнее всего, из мышечной и соединительной ткани, подкожно-жировой слой не изменен.
Спиральная КТ: в мягких тканях правой ягодичной области, под большой ягодичной мышцей визуализируется мягкотканое образование, размерами 6,8´4,8´8,8 см, неравномерно накапливающее контрастное вещество, больше в периферических отделах. Деструктивных изменений костных структур на уровне исследования не выявлено. Заключение: новообразование мягких тканей правой ягодичной области. Диффузные изменения печени.
18.08.2010 г. операция: дугообразный разрез длиной до 10 см над опухолью в области правой ягодицы. Гемостаз. Рассечена поверхностная фасция и частично большая ягодичная мышца. Тупым и острым путем выделено опухолевидное образование, белесовато-серого цвета, каменисто-хрящевидной плотности, размерами 9´6´4,5 см. Оказалось, что опухоль прорастает седалищный нерв и капсулу тазобедренного сустава, врастает в запирательное отверстие и интимно спаяна с крестцом. По частям удалено до 2/3 опухолевого массива. Гемостаз. Рана ушита до резиново-марлевого выпускника, поставленного к ее дну. Швы на кожу. Асептическая повязка. Макропрепарат: опухоль каменистой, местами хрящевидной плотности, белесовато-серого цвета, гомогенная, с кровоизлияниями. Общий размер удаленной части образования 6´3,5´3,5 см. Послеоперационный период протекал без осложнений. Рана зажила первичным натяжением. Патогистологическое заключение (№ 6401-34): агрессивный фиброматоз. 28.08.10 пациент выписан домой.
08.12.2010 г. ребенок консультирован детским онкологом в национальном институте рака г. Киева. Из-за прорастания опухолью седалищного нерва провести радикальную операцию не представляется возможным. Рекомендовано провести курс полихимиотерапии (ПХТ): метотрексат 30 мг/м 2 – 1 раз в неделю (№ 12); винбластин 6 мг/м 2 – 1 раз в неделю (№ 12), тамоксифен 10 мг/м 2 – ежедневно в течение трех месяцев. Опухолевидное образование уменьшилось в размере. Спустя 1,5 месяца курс ПХТ проведен повторно. Затем проведена телегамматерапия в суммарной дозе 45 Гр. на ложе опухоли. Опухоль уменьшилась до 2 см в диаметре. Мальчик повторно направлен в национальный институт рака для коррекции терапии.
Среди наших пациентов с экстраабдоминальной локализацией после радикальных операций рецидивы отмечены у 4 детей (33,3%), причем у 2 больных е- дважды. Они оперированы повторно, затем был проведен курс ПХТ: метотрексат, винбластин, блеоцин. Одному ребенку назначен курс телегамматерапии в суммарной дозе 60 Гр. Родители одного пациента от химиолучевой терапии отказались. Среди детей с интраабдоминальной локализацией у 4 опухоль располагалась в забрюшинном пространстве с прорастанием брыжейки кишечника. В одном случае опухоль удалена полностью, у двух – частично, у одного ребенка произведена только биопсия опухоли. Еще у 1 больной имел место АФ правого яичника и матки. После удаления опухоли наступило выздоровление. Приводим одно из наших наблюдений пациентов этой группы.
Больной П., 5 лет, поступил в клинику 25.11.1985 г. с жалобами родителей на увеличение в размерах живота ребенка, плохой аппетит. Из анамнеза известно, что в 1982 г. оперирован во Владивостоке по поводу синдрома портальной гипертензии. Произведена спленэктомия, краевая резекция печени, оментогепатодиафрагмопексия. После операции чувствовал себя удовлетворительно, а с августа 1985 г. замечено увеличение в размерах живота, в брюшной полости стало пальпироваться опухолевидное образование, ухудшился аппетит. Обследован по месту жительства, с подозрением на опухоль брюшной полости пациент доставлен в клинику.
При поступлении общее состояние средней тяжести. Кожные покровы бледные. Пониженного питания. Легкие и сердце без особенностей. Пульс до 100 ударов в минуту, удовлетворительных свойств. Живот резко увеличен в объеме, больше в эпигастральной и мезогастральной области, участвует в акте дыхания. Передняя брюшная стенка несколько пастозна, выражен венозный рисунок. По средней линии живота послеоперационный рубец, размером 15´0,5 см. В брюшной полости определяется плотное, бугристое, малоподвижное опухолевидное образование, уходящее верхним краем под печень, а нижним – на 3-4 см ниже пупка. Симптомов раздражения брюшины нет. Анализ крови: Hв – 110 г/л, эр. – 3,4 Т/Л, л. – 10,2 Г/Л, СОЭ – 44 мм/час. Анализ мочи без патологических изменений. Общий белок – 58,7 г/л, трансаминазы в пределах нормы. Диагноз: фибросаркома (лимфосаркома?) брюшной полости с прорастанием в забрюшинное пространство. 18.12.1985 г. после предоперационной подготовки больной оперирован.
В брюшной полости обнаружено плотное, мелкобугристое опухолевидное образование, исходящее из забрюшинного пространства, прорастающее брыжейку кишечника, деформирующее двенадцатиперстную кишку и поджелудочную железу, интимно спаянное с аортой и нижней полой веной, размером 16´12´9 см. На основании макроскопического вида образования высказано предположение в пользу обширной фибросаркомы (фиброматоза?) забрюшинного пространства. Опухоль признана иноперабельной. Произведена биопсия опухоли. Гистологическое заключение: агрессивный фиброматоз с наличием очагов воспаления.
Послеоперационный период протекал гладко. Рана зажила первичным натяжением. С учетом размеров опухоли и наличием воспалительных изменений в ней, решено провести 2 курса лучевой терапии по 85 Гр. с интервалом в 2,5 месяца. После первого курса образование значительно уменьшилось в размерах, а после второго перестало определяться. Больной осмотрен через 1, 2 и 5 лет после операции. Клинически и при обследовании данных, свидетельствующих о рецидиве опухоли, нет.
Выводы
1. Лечение агрессивного фиброматоза только хирургическим методом не всегда является эффективным, так как опухоль склонна к постоянному рецидивированию. По нашим данным, рецидивы при экстраабдоминальном расположении опухоли отмечены у 33,3% больных.
2. При интраабдоминальном расположении агрессивного фиброматоза радикальную операцию удалось выполнить только у 40% пациентов.
3. После повторной операции по поводу рецидива опухоли необходимо проводить химио-лучевую терапию.
4. Больные с агрессивным фиброматозом должны находиться на диспансерном учете, сонографический контроль необходимо проводить ежемесячно.
2. Грона В.Н. Опухоли и опухолеподобные образования у детей / В.Н. Грона, В.К. Литовка, И.П. Журило, К.В. Латышов. – Донецк: Норд-Пресс. – 2010. – 364 с.
3. О десмоидном фиброматозе у детей / В.П. Кононученко, В.К. Литовка, И.П. Журило [и др.] // Проблемні питання педіатріі, та вищої медичної освіти (II випуск): Зб. наукових праць. – Донецьк: Норд-Пресс. – 2008. – С. 164-165.
4. Результаты комбинированного лечения агрессивного фиброматоза у детей / М.С. Лосева, В.И. Ковалев, В.А. Стыков [и др.] // Материалы конф.: Достижения и перспективы детской хирургии. – СПб. – 2002. – С. 145.
5. Агресивний фіброз у дітей / А.А. Переяслов, І.С. Гоменюк, О.О. Трошков, М.П. Локодчак // Хірургія дитячого віку. – 2011. – № 2. – С. 62-65.
6. Low-dose chemotherapy with methotrexate and vinblastine for patients with advanced aggressive fibromatosis / A. Azzarelli, A. Gronchi, R. Bertulli [et al.] // Cancer. – 2001. – Vol. 92. – Р. 1259-1264.
7. Buitendijk S. Pediatric aggressive fibromatosis. A retrospective analysis of 13 patients and review of the literature / S. Buitendijk, C.P. Van de Ven, T.G. Dumans [et al.] // Cancer – 2005. – Vol. 104. – Р. 1090-1099.
8. Fletcher C.D.M. Word Healh Organisation Classification of Tumors. Pathology and Genetics of Tumours of Soft Tissue and Bone. / C.D.M. Fletcher, K.K. Unni, F. Mertens. – IARC: Lyon. – 2002.
9. Aggressive fibromatosis: a challenge for paediatric oncologikal surgery / J. Godzinski, W. Sulka, M. Rapala [et al.] // Pediatr. Blood cancer. – 2003. – Vol. 41. – Р. 278.

Содержание:
Десмоид, или агрессивный фиброматоз – это редкая опухоль, состоящая из соединительной ткани и развивающаяся из фасциально-апоневротических и сухожильных структур. Формально десмоид не является злокачественным новообразованием, так как он не пускает метастазы. Тем не менее, его быстрый рост и разрушение базальных мембран делают его похожим на злокачественную опухоль.
Из-за чрезвычайной редкости до сих пор не выведена статистика возникновения десмоида по возрастам. Больше всего больных имеют мужской пол, а встретиться десмоид может в возрасте от младенчества до глубокой старости.
Строение и причины появления десмоида. В начало
Источником опухоли при десмоиде становится фиброцит - клетка соединительной ткани. Когда в нем образуется чрезмерное количество бета-катенина, он трансформируется в клетку десмоида. Данный белок является регулятором нормальной активности фиброцита, и при его увеличении начинается чрезмерная активность, что и приводит к ускоренному росту и возникновению опухоли.
ВАЖНО: У взрослых пациентов хорошие результаты дает лечение десмоида лучевой терапией, причем можно стабилизировать даже регрессию новообразования.
Существует несколько причин увеличения выработки бета-катенина. Одна из них – мутация в гене APC, отвечающем как раз за внутриклеточную регуляцию количества В-катенина. Другая причина – гиперпродукция PDGF, тромбоцитарного фактора роста, из-за чего опять же увеличивается содержание В-катенина. Нередко десмонид появляется во время беременности, а также в местах инъекций эстрогенов в мышцы. Иногда десмоид может развиваться в местах хирургических операций, травм и простых внутримышечных инъекций.
Статистика заболевания.В начало
Десмоид – это весьма редкая патология. Врачи фиксируют около 2-4 случаев на миллион человек в год, а доля десмоида среди других опухолей мягких тканей составляет всего 0,03-0,1%. Из-за низкой частоты патологии серьезно затруднено ее изучение и систематизация накопленного опыта. Например, среди публикаций 2000-2004 года примерно треть статей описывает лишь один клинический случай, а самые значимые из них приводят данные всего лишь о 18, 72 и 83 пациентов за четверть века наблюдений.
Симптомы десмоида. В начало
Десмоид может наблюдаться в любой области организма, где есть соединительная ткань. Если новообразование локализуется в конечностях, то оно возникает только на сгибательных поверхностях, то есть в ягодичной области, на бедрах, на задней поверхности голени, на передних поверхностях предплечья и плеча. Источником роста опухоли всегда являются глубокорасположенные ткани, что позволяет отличить его от других опухолей.
Внешний вид десмоида
Опухоль растет обычно очень медленно, причем после рецидива десмоид быстро вырастает до размеров недавно удаленной опухоли, а иногда и превосходит ее. Нередко возникает несколько опухолей, распространенных на одной анатомической области.
Внешне десмоид выглядит как плотная, практически несмещаемая опухоль, располагающаяся в глубине мышц или так или иначе связанная с мышечным массивом. Также пациент может чувствовать болевые ощущения.
ВАЖНО: Больше всего больных имеют мужской пол, а встретиться десмоид может в возрасте от младенчества до глубокой старости.
Диагностика десмоида. В начало
Диагностика опухоли необходима для определения ее гормонального фона, оценки статуса новообразования и появления наиболее рационального способа ее лечения. Также при диагностике определяются границы опухоли, ее близость к сосудам, что очень важно для планирования операции. Чаще всего для диагностики десмоида используют МРТ, так как оно позволяет с высокой точностью определить границы опухоли. Также бывает необходим анализ крови на различные компоненты, УЗИ и множество других процедур. Чем больше будет проведено диагностических процедур, тем точнее получится определить характер опухоли, ее размеры и течение заболевания.
Классификация. В начало
В медицине существует классификация десмоидных фибром. Выделяется четыре группы:
Группа А – опухоль до 5 см.
Группа Б - опухоль от 5 до 10 см.
Группа В - опухоль от 11 до 20 см.
Группа Г - опухоль более 20 см.
Лечение десмоида. В начало
Хирургическое лечение десмоида не приносит нужных результатов – примерно у 70% больных, подвергшихся операции, наблюдались местные рецидивы. Риск рецидива никак не зависит от пола и локализации оперируемой опухоли и связан в первую очередь с агрессивностью самого десмоида. В современной медицине использование только хирургического лечения признается ошибочным.
Консервативное лечение
У взрослых пациентов хорошие результаты дает лечение десмоида лучевой терапией, причем можно стабилизировать даже регрессию новообразования. Химиотерапия на детях не применяется, так как в облученных областях могут закрыться зоны роста костей, что приведет к серьезной деформации скелета.
Сейчас десмоид у детей лечат операцией и длительной (до двух и более лет) терапией антиэстрогеновыми препаратами и цитостатиками в низких дозах. Лекарственное лечение проводится как до, так и после операции.
Лекарственная терапия у детей
Цель любого дооперационного лечения – ограничить новообразование от тканей вокруг, уплотнить его, стабилизировать и уменьшить в размерах. Послеоперационная терапия применяется для профилактики рецидива из микроскопических остатков опухоли.
Если у пациента диагностируется рецидив, то новое лечение начинается с химиогормональной терапии.
Хирургическое лечение
Главное требование к хирургическому лечению данной опухоли – радикальность операции. Если десмоид локализуется на мягких тканях конечностей, то полностью исключить рецидив можно с помощью ампутации. Такую органоуносящую операцию практикуют только в том случае, если опухоль вросла в сустав, проросла в магистральные сосуды или имеет гигантские размеры.
Чтобы сохранить орган, необходимо тщательно иссечь все узлы новообразования. Если десмоид локализуется в ягодичной области или мягких тканях бедра, то в десмоид может оказаться вовлечен седалищный нерв, что приводит к невозможности радикального вмешательства – седалищный нерв пересекать нельзя, а без его пересечения невозможно полностью удалить опухоль. То же самое возникает при локализации опухоли в нервных стволах верхних конечностей.
Из-за большого размера узлов опухоли, наличия больших послеоперационных рубцов и недостатка тканей после операций серьезной проблемой является пластика дефектов, вызванных операциями по иссечению опухоли. Особенно эта проблема актуальна, если десмоид локализуется в области живота или грудной клетки. В этом случае для закрытия появившихся дефектов рекомендуют полипропиленовую сетку или другие синтетические пластические материалы.
Прогноз. В начало
При проведении серьезного комбинированного лечения, включающего в себя радикальную хирургическую операцию и длительную химическую и гормональную терапию, рецидивы наблюдаются только у 15-10% пациентов.
Чаще всего рецидивируют опухоли на задней поверхности голени или в тканях стопы. Обычно рецидив наступает через три года после операции. Гибель больных может имеет место, только если новообразования прорастают в жизненно важные места и оказываются устойчивы к химиотерапии. Такое случается, если десмоид локализуется в области шеи, головы или грудной клетки.
Можно ли беременеть при десмоиде. В начало
Десмоид не является злокачественной опухолью, однако при его наличии в организме беременеть все равно не рекомендуется. Это связано с тем, что для лечения опухоли требуются очень серьезные лекарства, а порой даже лучевая терапия. Поэтому на время наличия в организме опухоли беременность лучше отложить.
А вот если опухоль успешно вылечена, то противопоказаний к беременности нет. Хотя некоторые специалисты все же рекомендуют подождать некоторое время, чтобы убедиться, что десмоид не появится снова.
Фиброма десмопластическая
Десмопластическая фиброма (син.: десмоид, фиброма десмоидная, фиброма инвазивная, фиброма агрессивная) — соединительнотканное новообразование, развивающееся из сухожильных структур; у детей характеризуется быстрым инфильтративным ростом. Неинкапсулирована, способна прорастать окружающие ее мышцы, интимно связана с окружающими мягкими тканями. Склонна к рецидивированию.
Макроскопически десмопластическая фиброма — плотная бугристая опухоль, не имеющая оболочки, на разрезе серого цвета. Микроскопически состоит из зрелых клеточных и волокнистых структур. Опухоль встречается редко. В нашей клинике оперированы 5 детей в возрасте от 1 года 8 мес до 9 лет. У одного ребенка опухоль локализовалась в области нижней губы и подбородка, у 2 детей — в поднижнечелюстном треугольнике и у 2 — на боковой поверхности шеи. Редкую локализацию десмопластических фибром в области шеи у взрослых отмечают А. И. Пачес (1971), Г. В. Фалилеев (1978), J. Masson и F, Soule (1966).
Главной особенностью десмопластических фибром Г. В. Фалилеев считает склонность к рецидивированию. Из 5 оперированных нами детей рецидивы опухоли возникли у мальчика 9 лет, у которого опухоль локализовалась в области нижней губы и подбородка. Десмонды не дают метастазов и относятся к опухолям местно-деструирующего роста. В качестве примера приводим одно из наблюдений.
Больная Д., 4 лет, поступила в клинику с диагнозом: саркома боковой поверхности шеи. Родители заметили опухоль за 5 мес до обращения в клинику. Опухоль овальной формы, с бугристой поверхностью, локализовалась в области левой кивательной мышцы, мягкие ткани над опухолью подвижны, вся поверхность опухоли, прилегающая к кивательной мышце, неподвижна.
На операции установлено, что опухоль размером 7х4 см деревянистой плотности не имеет выраженной оболочки, инфильтрирована, прорастает в толщу мышцы и плотно прилегает к фасциальному сосудистому ложу шеи. Опухоль удалена полностью с частью кивательной мышцы, фасцией, покрывающей сосуды шеи, и частью яремной вены. Ребенок находился под наблюдением около 3 лет, рецидива не выявлено.
Фиброангиома основания черепа
Высказанное G. Gosselin (1873) мнение, что после 25 лет наступает постепенная инволюция опухоли, на наш взгляд, требует уточнения. Кроме того, особенности расположения и распространения опухоли в большинстве случаев не позволяют принять выжидательную тактику.
Фиброангиома основания черепа включена в данную работу в связи с особенностями клинического проявления ее в детском возрасте: опухоль распространяется в полость носа, проникает в верхнечелюстную пазуху и деформирует кости носа и верхней челюсти. Детский стоматолог нередко является врачом, к которому впервые обращается больной и от которого зависит план и тактика лечения.
В клинике лучевой терапии кафедры рентгенологии и радиологии ММСИ находились на лечении 115 больных (все мужского пола) с гистологически верифицированным диагнозом фиброангиомы основания черепа. Распределение больных по возрасту представлено в табл. 4.
Таблица 4. Распределение больных фиброангиомами основания черепа по возрасту

В клинику и поликлинику кафедры стоматологии детского возраста были направлены 12 мальчиков в возрасте 10-12 лет, из которых 8 были оперированы, а 4 направлены на лучевую терапию в клинику.
Первые симптомы заболевания — затруднение носового дыхания и появление слизистых выделений из носа. Эти симптомы нарастают, при отеке слизистой оболочки или сдавлении слуховой трубы возникают тугоухость, ринолалия. Частые носовые кровотечения, вызывающие анемию, могут быть первым проявлением заболевания, по поводу которого больные обращаются за врачебной помощью.
В зависимости от преимущественного направления роста опухоли выделяют три основных типа: сфеноэтмоидальныи, базальный (базиссфеноидальный) и птеригомаксиллярный. Наиболее часто встречающаяся опухоль сфеноэтмоидального типа распространяется на переднебоковую, реже на заднебоковую поверхность тела основной кости, в зону медиальной пластинки крыловидного отростка и в задние клетки решетчатого лабиринта.
При своем развитии опухоль прорастает в основную пазуху, носоглотку, крылонебную и подвисочную ямки, глазницу, среднюю и реже переднюю черепную ямку со сдавлением гипофиза и зрительных нервов. Опухоль базиссфеноидального типа, захватывая свод носоглотки и основной части затылочной кости, прорастает в носоглотку, полость носа, ротоглотку, полость черепа.
В стоматологические клиники, как правило, поступают больные с опухолями птеригомаксиллярного типа, основное направление роста которых — вниз и вперед. Опухоль выполняет носоглотку и проникает в полость носа, разрушает заднюю и медиальные стенки одной из верхнечелюстных пазух и выполняет ее, оттесняет дно глазницы.
Клинические симптомы: экзофтальм, деформация наружной поверхности верхней челюсти, выбухание твердого неба, в отдельных случаях — оттеснение тканей мягкого неба в ротовую полость, полное отсутствие носового дыхания. Деформирующие и выбухающие участки верхней челюсти упругоподатливы при пальпации. При полном нарушении кости (атрофия вследствие сдавления) поверхность опухоли податлива, гладкая или несколько бугристая. Слизистая оболочка носа и полости рта, покрывающая опухоль, яркой окраски с участками расширенных капилляров, отмечаются частые носовые кровотечения. Из носовых отверстий выделяется большое количество слизи с примесью крови.
Ввиду особенностей клинического течения юношеских ангиофибром основания черепа (малосимптомное развитие в начальных стадиях, подчас длительное течение с нарушением лишь носового дыхания) их обычно диагностируют поздно, при значительном распространении опухоли. При переходе опухоли до надгортанника возникает затруднение дыхания, что может привести к развитию асфиксии, в связи с чем может возникнуть необходимость в неотложной трахеостомии.
Хотя темп развития опухоли у разных больных неодинаков и встречаются случаи, когда наблюдается ее быстрый и агрессивный рост, озлокачествление происходит лишь в единичных случаях [Donald P. J., 1978].
При анализе обзорных рентгенограмм костей лицевого черепа, выполненных в прямой и боковых проекциях, можно определить степень разрушения и деформации верхней челюсти, дна глазницы, носовой перегородки. Специальное дополнительное исследование проводят в трех проекциях: боковой с центрацией на область носоглотки, подбородочно-носовой с широко открытым ртом и задней аксиальной с последующей томографией, которая позволяет установить распространенность процесса.
У больных с фиброангиомой выявляют мягкотканные затемнения в области носоглотки. Мягкотканная тень с четким передним контуром у большинства больных занимает не только область носоглотки, но и распространяется книзу до уровня угла нижней челюсти. При росте кпереди опухоль проникает в полость носа, вначале закрывая лишь хоаны, в крылонебную ямку, смещая в дальнейшем заднюю стенку верхнечелюстной пазухи кпереди. Ортопантомограмма позволяет оценить состояние крылонебной и подвисочной ямок, крылонебного отростка основной кости и задней стенки верхнечелюстной пазухи. Иногда передний контур мягкотканной тени опухоли имеет крупнофестончатый характер.
При прорастании фиброангиомы в верхнечелюстную пазуху на рентгенограммах, выполненных в подбородочно-носовой проекции, определяется ее затемнение. При распространении опухоли в основную пазуху изображение ее нижней стенки вначале становится менее четким, а затем появляется мягкотканная тень, занимающая нижние отделы пазухи. При вовлечении в процесс клеток решетчатого лабиринта выявляют их затемнение.
Ангиографию проводят с целью определения прорастания опухоли в полость черепа и решения вопроса о проведении эндоваскулярного лечения (эмболизация). Более безопасным методом изучения распространенности процесса является компьютерная томография.
Анализ рентгенограмм свидетельствует о том, что фиброангиомы возникают в заднебоковых отделах полости носа — в месте прилежания крыла сошника к клиновидным отросткам небной кости и основанию крыловидных отростков клиновидной кости. В связи с этим мы предлагаем называть данное образование фиброангиомой постназального пространства.
Результаты клинико-рентгенологического обследования 127 детей и подростков, находившихся под нашим наблюдением, свидетельствовали о наличии почти у всех распространенной опухоли, занимающей носоглотку и смежные анатомические области — пазуху основной кости, клетки решетчатого лабиринта, верхнечелюстную пазуху, глазницу, полость носа, ротоглотку. У 11 больных выявлены признаки распространения опухоли в полость черепа.
Богато васкуляризованная опухоль состоит из плотной соединительной ткани, эластических волокон и многочисленных гнезд незрелых соединительнотканных клеток. В периферических отделах выявляют большое количество сосудов эмбрионального типа. Встречаются сосуды на разных стадиях развития, многочисленные артериальные анастомозы, тонкостенные: венозные лакуны. Опухоль плохо инкапсулирована, имеет тонкую соединительнотканную оболочку, которая в местах прилегания к мышцам и слизистой оболочке не выявляется.
При обширный опухолях, радикальное удаление опухоли технически трудно выполнимо и сопровождается значительной кровопотерей. Обильное кровотечение при удалении опухоли возникает при выделении ее полюса, прилегающего к клиновидной кости и ее крыловидным отросткам [Amedee R., Klaeyle D., Mann W., Geyer H., 1989].
Хирургический доступ у оперированных нами больных осуществлялся и через костное окно, образованное путем удаления передней поверхности верхнечелюстной кости и резекции альвеолярного отростка верхней челюсти (чаще от 3 до 7 последних зубов).
Опухоль сравнительно легко выделялась в области верхнечелюстной пазухи и полости носа, технически трудно — в задних и верхних отделах. У всех больных рану после операции тампонировали отжатым марлевым тампоном, смоченным линиментом синтомицина. У 5 оперированных рана со стороны полости рта была ушита наглухо, конец тампона выведен в полость носа. Дети находились под наблюдением в течение 1-3 лет. Признаков повторного роста выявлено не было.
Наш клинический опыт позволяет считать хирургическое лечение этой группы больных нецелесообразным, так как оно заключается в выполнении уродующей операции и сопровождается значительной кровопотерей. После разработки методики лечения ангиофибром основания черепа у детей с помощью лучевой терапии на кафедре, руководимой проф. Ю. И. Воробьевым, мы полностью отказались от хирургического лечения данных больных.
Противоречивое отношение к лучевой терапии юношеских фиброангиом объясняется ограниченными возможностями применяемых методик (ортовольтная рентгенотерапия, внутритканевая у-терапия), тем, что проводится оценка лишь непосредственных результатов лечения, а также небольшим количеством наблюдений у каждого автора.
Опыт лечения 74 больных с морфологически верифицированными юношескими ангиофибромами основания черепа, начиная с 1963 г., позволяет нам рекомендовать следующую лечебную тактику [Воробьев Ю. И., Саранцева И. П., 1977].
У всех больных с распространенными фиброангиомами основания черепа на первом этапе должно быть осуществлено лучевое лечение в виде дистанционной у-терапии. Курс такого лечения состоит из двух этапов: первый — 20 Гр за 10 облучений с перерывом между этапами 2 мес, второй — 25 Гр за 10 облучений.
Дистанционную у-терапию осуществляют с двух встречных околоушных боковых полей размером 6х6 или 5-6 см. В зону облучения обязательно должна быть включена исходная точка возникновения опухоли. Клинико-рентгенологические данные, полученные при динамическом наблюдении, свидетельствуют о том, что темпы послелучевой регрессии опухоли не отличаются от таковых при облучении с больших полей (размером 6х8, 8х10 см).
При клинико-рентгенологическом обследовании больных через 2 мес после первого курса мы ни разу не наблюдали прогрессивного роста опухоли, к началу второго курса состояние больных, как правило, улучшалось в связи с прекращением кровотечений и частичным восстановлением носового дыхания, а клинико-рентгенологические данные свидетельствовали о некотором уменьшении опухоли. Возникала возможность дальнейшего уменьшения полей облучения. Это обстоятельство, а также .пролонгированное двухэтапное облучение, несомненно, более благоприятны в смысле снижения риска послелучевых осложнений.
Начиная с 1975 г., мы используем модифицированную методику лучевого лечения малыми полями с включением в зону лучевого воздействия лишь исходной точки роста опухоли. Сфероидальный фрагмент и особенно нижний фрагмент опухоли, распространяющийся подчас до уровня СI-СIII, не включают в объем облучения. Тем самым уменьшается объем облучаемых тканей, в частности околоушных желез, глотки, уменьшаются выраженность местных и общих лучевых реакций и риск послелучевых осложнений.
Размеры и расположение полей определяют у каждого больного индивидуально, а правильность центрации контролируют с помощью рентгенограмм или электрорентгенограмм с координационной сеткой. Используют два боковых противолежащих поля размером 3х4 или 5х5 см.
У больных с особо агрессивным течением, внутричерепной инвазией опухоли проводят один курс дистанционной у-терапии с суммарной очаговой дозой 45 Гр за 4,5 нед (ритм — 5 облучений в неделю). После окончания лучевой терапии оперативное вмешательство проводят при наличии остатков опухоли, вызывающих клинические проявления, и возобновлении роста опухоли.
Из 115 больных с фиброангиомами основания черепа, подвергшихся лучевому и комбинированному лечению, у 34 человек срок наблюдения не превышал 3 лет, и оценка результатов лечения больных этой группы в данной работе не проводится.
Все больные живы. У 50 из них лучевая терапия явилась методом выбора, а у 31 больного дистанционная у-терапия проведена в комбинации с оперативным вмешательством. Распределение больных с учетом результатов лечения и сроков наблюдения представлено в табл. 5.
Таблица 5. Результаты лучевого и комбинированного лечения юношеских фиброангиом основания черепа

Попытка радикального оперативного вмешательства в качестве самостоятельного лечения в этих случаях, как правило, оказывается неэффективной, чревата опасностью кровотечения, вызывающего летальный исход, и, более того, не избавляет больного от необходимости последующего облучения.
Таким образом, все больные (кроме 2, подвергшихся лучевому или комбинированному лечению) живы, из них у 52 достигнуто полное и стойкое излечение, 16 больных практически здоровы, только при рентгенологическом исследовании у них определяется остаточная тень у места исходного роста опухоли (не исключено, что это рубцовая ткань) без каких-либо клинических проявлений. Однако эти больные нуждаются в дальнейшем наблюдении.
Всем больным с рецидивами произведено оперативное вмешательство, в настоящее время они здоровы. Смертельный исход у одного из 2 умерших больных был вызван кровотечением во время операции. У другого спустя 9 лет после лучевого лечения и последующей операции вновь был отмечен бурный рост опухоли, которая при гистологическом исследовании оказалась ангиосаркомой; больной умер от кровотечения.
Случаи озлокачествления опухоли с переходом в ангиосаркому редки, однако описаны рядом авторов, причем некоторые из них связывают озлокачествление с предшествующей лучевой терапией [Батюнин И. Т., Thomson L. et al., Wilson С. Р.]. Вряд ли следует считать озлокачествление опухоли у наблюдавшегося нами больного следствием проведенной лучевой терапии, так как описаны случаи озлокачествления опухоли у больных, которым не проводили облучение. Однако нельзя полностью исключить такую возможность, в связи с чем еще более возрастает необходимость дальнейшего совершенствования методов лучевой терапии.
На основании нашего опыта мы считаем возможным высказать свое мнение относительно оптимальной суммарной очаговой дозы. Вопреки мнению S. Bach и соавт., рекомендовавших высокие дозы (60-70 Гр), а также Е. L. Fraser и соавт., предлагавших использовать дозы 30-40 Гр, мы считаем, что суммарная очаговая доза должна быть не ниже 40-45 Гр. Мы ни у одного больного не наблюдали каких-либо нарушений развития костей лица или лучевых осложнений. Дистанционная у-терапия (30-35 Гр за 10 облучений) у 45 больных с ангиофибромой (из них 10 поступили с рецидивами после оперативных вмешательств) обеспечила контроль в 80% случаев при сроках наблюдения от 2 до 20 лет [BriantF. D. R. etal., 1978].
При небольших размерах опухоли осуществляют оперативное вмешательство или криовоздействие. Хирургический доступ в виде боковой ринотомии позволяет удалить опухоли из верхнечелюстной пазухи и глазницы [Harrison D. р., 1977]. В случаях локализации опухоли в крылонебной ямке производят разрез по Веберу-Фергюссону.
Колесов А.А., Воробьев Ю.И., Каспарова Н.Н.
Читайте также:


