Травма спинного мозга на крысах

Лечение пациентов с травматическим повреждением спинного мозга остается одной из сложнейших задач современной нейробиологии и нейрохирургии, для решения которой учеными разных стран проводятся экспериментальные исследования на животных. Несмотря на большое количество работ, посвященных моделированию контузионной травмы спинного мозга у крыс, осложнения, с которыми сталкиваются экспериментаторы, практически не описаны. В некоторых работах упоминается единственное осложнение – гематурия, зачастую приводящая к гибели экспериментальных животных [2, 9]. Ряд авторов, описывающих эту проблему, проводят только антибиотикопрофилактику инфекционных осложнений мочевыделительной системы [5, 6, 7, 8]. Вместе с тем, при травме спинного мозга у человека возникает целый ряд осложнений, в виде дисфункции тазовых органов, сосудистых и нейротрофических нарушений, инфекционно-воспалительных процессов [1].
Цель исследования – выявить возможные осложнения при моделировании контузионной травмы спинного мозга у крыс.
Материалы и методы исследования
Воспроизводили стандартную модель контузионной травмы спинного мозга средней степени тяжести [3]. Оперативное вмешательство осуществляли под общей анестезией (Рометар 2 % – 0,2 мл, Золетил 100 – 0,2 мл). Выполняли ламинэктомию на уровне ТIX, позвоночный столб жестко фиксировали за остистые отростки ТVIII и ТХ позвонков и производили контузию спинного мозга цилиндрическим грузом диаметром 1,8 мм массой 10 г с высоты 25 мм при помощи импактора собственной конструкции. После нанесения травмы происходило рефлекторное вытягивание тазовых конечностей. Операционную рану ушивали послойно, наглухо. Однократно подкожно вводили 5 мл 0,9 % раствора хлорида натрия. После операции животных помещали в индивидуальные клетки. В течение первых суток осуществляли дополнительный обогрев. Доступ к воде и корму не ограничивали. Максимальный срок клинического наблюдения за животными составлял 180 суток.
На 1, 3, 5, 7 сутки после операции проводили клинический анализ мочи с помощью тест-полосок Aution Sticks 10EA (Arkray Factory Inc., Japan) на автоматическом анализаторе PocketChem UA PU-4010 (Arkray Factory Inc., Japan) и микроскопическое изучение мочевого осадка.
Микробиологические исследования мочи осуществляли традиционным методом посева на плотные питательные среды. Идентификацию выделенных культур проводили на автоматическом бактериологическом анализаторе WalkAway® 40 plus (Siemens Healthcare Diagnostics Inc., США), их чувствительность к антибиотикам определяли диск-диффузионным методом на агаре Мюллера-Хинтона.
Результаты исследования и их обсуждение
В результате того, что у наркотизированных крыс веки не смыкаются, происходит высыхание конъюнктивы и роговицы глаза с последующим развитием кератоконъюктивита. Для профилактики данного осложнения во время выполнения оперативного вмешательства применяли стерильное вазелиновое масло.
Неврологический статус всех прооперированных животных на момент выхода из наркоза соответствовал 0 баллов по шкале ВВВ [3]. В раннем послеоперационном периоде у 5 (11,4 %) животных отмечалась острая полная ишурия, у 28 (63,6 %) – острая неполная и у 11 (25 %) ишурия не была выявлена. В позднем послеоперационном периоде у 1 крысы диагностирована хроническая неполная ишурия. У животных с неполной ишурией шерсть в области живота и внутренней поверхности бедер была влажная, наблюдалась мацерация кожи. Всем животным с задержкой мочи два раза в сутки осуществляли мануальное опорожнение мочевого пузыря и выполняли туалет наружных половых органов и паховой области.
В течение первых суток после операции у 36 (81,8 %) животных развивалась тотальная макрогематурия разной степени выраженности. Цвет мочи варьировал от розово-красного до темно-вишневого. В ряде наблюдений при опорожнении мочевого пузыря происходило выделение кровяных сгустков темно-красного цвета. У 8 (18,2 %) крыс выявлена микрогематурия.
При патологоанатомическом вскрытии трупов 3 (6,8 %) животных, павших в раннем послеоперационном периоде, наблюдали сильно увеличенный мочевой пузырь, содержащий до 5–7 мл мочи темно-красного цвета со взвесью (рис. 1). Стенка мочевого пузыря была истончена, кровеносные сосуды резко расширены, на слизистой оболочке очаговые кровоизлияния. Мочеточники утолщены. Почки бобовидной формы, не увеличены, на разрезе между корковым и мозговым слоями имели четкую границу.
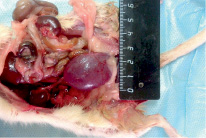
Рис. 1. Патологоанатомические изменения мочевыводящей системы крысы при гематурии
Гемостатическую терапию осуществляли путем внутримышечного введения Этамзилата в дозе 0,02 мл 2 раза в сутки на протяжении 3 дней. При этом у животных с микрогематурией уже на 3 сутки эксперимента эритроциты в моче отсутствовали, а с макрогематурией они исчезали на 5–7 сутки. У 1 крысы, несмотря на проведенную комплексную терапию, макрогематурия сохранялась до 15 суток эксперимента.
При отсутствии гемостатической терапии и назначении в послеоперационном периоде препарата Энрофлокс 5 % (подкожно, 5 мг/кг) у трех животных из четырех на 4–5 сутки эксперимента развилась пиурия. При проведении бактериологического исследования содержимого мочевого пузыря выявлены Propionibacterium sp., Acinetobacter sp., Staphylococcus haemolyticus, наиболее чувствительные к гентамицину и ципрофлоксацину. В последующем, при назначении животным гентамицина (4 мг/кг) и этамзилата в указанной дозе ни у одного животного пиурия не наблюдалась.
Также у большинства животных на следующий день после операции регистрировалась хромодакриорея (образование темно красных корочек вокруг глаз и/или ноздрей), которая может возникать при стрессовых ситуациях (рис. 2) [4]. Ее признаки исчезали без дополнительного вмешательства на 3–5 сутки.
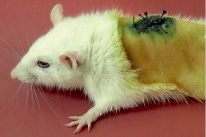
Рис. 2. Хромодакриорея
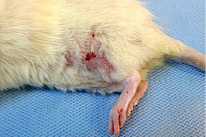
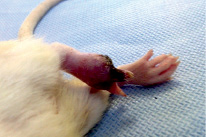
Рис. 3. Осложнения в отдаленном периоде эксперимента: а – эрозия кожи в области коленного сустава; б – аутомутиляция пальцев тазовой конечности
У многих крыс каудальнее уровня травмы развивались очаговые алопеции, однако через 1,5–2,5 месяца шерстный покров полностью восстанавливался. У 8 (18,2 %) животных на 83–114 сутки эксперимента отмечалось образование поверхностных кожных эрозий и трофических язв с преимущественной локализацией в области латеральной поверхности тазовых конечностей (рис. 3, а). При данном осложнении для предотвращения присоединения вторичной инфекции ежедневно выполняли туалет раны (удаление некротических участков, обработка 0,02 % водным раствором фурацилина) с последующей аппликацией мази Левомеколь. У 1 животного наблюдалась аутомутиляция пальцев левой тазовой конечности (рис. 3, б).
Заключение
Таким образом, у крыс после моделирования контузионной травмы спинного мозга, возможно возникновение различных осложнений. В раннем послеоперационном периоде большая вероятность развития ишурии, гематурии и хромодакриореи; в отдаленном периоде эксперимента – нейротрофических расстройств, проявляющихся образованием очаговых алопеций, кожных эрозий и трофических язв, а также возникновение аутомутиляции.
Полученные сведения необходимо учитывать при выполнении исследований в области экспериментальной нейрохирургии.
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
На модели контузионной травмы спинного мозга крысы на уровне Тh9 исследовано влияние на структуру спинного мозга немедленной трансплантации клеток обонятельной выстилки человека в область повреждения. Без иммуносупрессии введенные клетки присутствуют в белом веществе не менее 7 сут. после трансплантации на расстоянии 2 см от точек введения как в ростральном, так и в каудальном направлениях. Показана их миграция в область очага повреждения и скопление по его периферии. При введении клеток установлено значимое уменьшение области деструкции к 30 и 60 сут. эксперимента в сером и, особенно, в белом веществе. Трансплантация клеток к 30 сут. вызывает существенное снижение размеров патологических полостей в белом веществе с наибольшим проявлением эффекта в передних канатиках. В непосредственной близости от области введения клеток (на расстоянии 3 мм от эпицентра травмы) показано увеличение количества сохранённых миелиновых волокон белого вещества.
Контузионная травма спинного мозга (КТСМ) вызывает комплекс патологических сдвигов, включающий гибель нейронов и глиальных клеток, дегенерацию нервных волокон, демиелинизацию, активацию микроглии и макрофагов. Эти нарушения являются причиной устойчивого функционального дефицита, усугубляемого естественными лимитирующими нейрорегенерацию факторами в ЦНС. Среди кажущихся перспективными немногочисленных экспериментальных подходов стимулирования посттравматической регенерации спинного мозга одно из ведущих мест принадлежит клеточной терапии. Трансплантируемые клетки необходимы для восстановления тканевого матрикса и формирования направляющих путей для роста аксонов, поддержания выживания нейронов и глиальных клеток, удлинения аксонов, стимулирования процесса миелинизации. На сегодняшний день одним из критериев отбора клеток, предназначенных для трансплантации, становится возможность трансфекции терапевтическими генами с высокой эффективностью их экспрессии в ткани реципиента. Этим условиям в разной степени удовлетворяют клетки нескольких типов, трансплантируемых при экспериментальной травме спинного мозга. Особый интерес вызывают работы, выполненные с трансплантацией мультипотентных мезенхимных стромальных клеток и нейральных (глиальных) клеток обонятельных структур, обонятельной луковицы и особенно обонятельной выстилки (КОВ). Последние улучшают восстановление функции при травме спинного мозга у грызунов, что послужило основанием для проведения клинических испытаний в некоторых странах [15] . КОВ человека обладают способностью стимулировать регенерацию и миелинизацию поврежденных аксонов спинного мозга крысы и частично восстанавливать двигательную и чувствительную функции [1, 2, 6] . КОВ продуцируют комплекс нейротрофических факторов, белки внеклеточного матрикса и молекулы адгезии нервных клеток. Интерес к КОВ подкреплен возможностью аутотрансплантации, не приводящей к длительному нарушению обоняния. Несмотря на значительное количество исследований с применением клеток данного типа для трансплантаций в спинной мозг, многие вопросы их поведения в ткани реципиента, а также влияние на конкретные события посттравматической дегенерации спинного мозга остаются неясными.
Нашими предыдущими исследованиями на модели КТСМ крысы показано, что трансплантация КОВ человека в область травматического повреждения обеспечивает улучшение двигательной функции в среднем на 11% (по критерию ВВВ) [3] . В настоящей работе на той же экспериментальной модели проведена оценка эффективности трансплантации КОВ человека на основе морфологических критериев.
Материал и методы
Работа выполнена на 37 крысах весом 250– 300 г. Животных содержали в стандартных условиях со свободным доступом к воде и пище. Животных после КТСМ, проводимой на уровне Th9 под наркозом по ранее описанной методике [4] , разделили на опытную (n = 18) и контрольную (n = 19) группы. Сразу после контузии животным опытной группы в две точки ростральнее и каудальнее от эпицентра травмы вводили КОВ человека в количестве 1,5 млн клеток на крысу. Животным контрольной группы проводили аналогичные инъекции, но без клеток. Методики получения, культивирования и введения КОВ описаны ранее [2, 3] .
Через 7, 30 и 60 сут. после травмы животных наркотизировали и транскардиально перфузировали охлажденным (4°С) 4% раствором параформальдегида. Забирали фрагмент спинного мозга длиной 5 см вместе с позвонками. Через 12 ч от начала фиксации спинной мозг отделяли от позвонков, разделяли на 5 фрагментов длиной 1 см каждый, нумеровали их с рострального конца для дофиксации и последующей идентификации.
Материал, эксплантированный на 7 сут. после операции, выдерживали в 30% растворе сахарозы и использовали для изготовления криостатных срезов, в которых визуализировали меченые СFDA-SE трансплантированные КОВ с помощью микроскопа Zeiss Axio Imager A1 в режиме флюоресценции. Ядра клеток дополнительно окрашивали специфическим красителем ДНК – DAPI (Sigma) – в концентрации 10 мкг/мл в течение 10 мин. Срезы промывали в PBS (3 раза по 15 мин), заключали в глицерин и просматривали на конфокальном сканирующем микроскопе LSM 510-Meta (Carl Zeiss).
Материал, забранный на 30 и 60 сут. после операции, дофиксировали в глутаральдегиде и четырехокиси осмия, обезвоживали и заливали в эпон 812. На ультрамикротоме LKB III получали полутонкие поперечные срезы спинного мозга для морфометрии и ультратонкие срезы для электронномикроскопического исследования.
На полутонких срезах, окрашенных метиленовым синим, измеряли площадь области деструкции серого и белого веществ в эпицентре и на расстоянии 3, 5, 16 и 24 мм; считали суммарную площадь патологических полостей и количество миелиновых волокон на расстоянии 3 и 5 мм ростральнее и каудальнее эпицентра травмы в 4 зонах белого вещества: 1 зона – вентро-медиальная часть переднего канатика, правая сторона; 2 – то же, левая сторона; 3 – латеральная часть бокового канатика в пределах фронтальной плоскости, проходящей через центральный канал, правая сторона; 4 – то же, левая сторона. Суммарную площадь патологических полостей и количество миелиновых волокон оценивали в площади среза 0,09 мм2 при увеличении ×250. Суммарную площадь поврежденного серого и белого вещества измеряли при увеличении ×40. Морфометрию осуществляли на микроскопе Carl Zeiss JENS NU2.
Ультратонкие срезы контрастировали уранилацетатом и цитратом свинца. В пределах тех же 4 зон с помощью электронного микроскопа JEM-1200 EX подсчитывали количество миелиновых волокон диаметром не более 9 мкм в трех полях зрения при увеличении ×8000. Для статистической обработки результатов применяли t-критерий Стьюдента.
Результаты

КТСМ вызывает глубокие деструктивные изменения, как в сером, так и в белом веществе. Общая их картина на данной модели у крысы детально описана нами ранее [5] . Меченые CFDA-SE трансплантированные КОВ человека выявлены в дорсальном отделе белого вещества (рис. 1) через 7 сут. после КТСМ и одновременного введения клеток. Трансплантируемые КОВ выживают в поврежденной ткани и мигрируют из точки введения на расстояние до 2 см как в ростральном, так и в каудальном направлениях. Кроме того, они мигрируют в область очага и скапливаются преимущественно по его периферии. Меченые CFDA-SE клетки присутствуют в сохраненной ткани белого вещества, проникая также в формирующиеся патологические полости.
К 30 сут. эксперимента на всех изучаемых расстояниях от эпицентра травматического повреждения в группе животных с трансплантацией клеток установлено уменьшение области деструкции серого вещества. Так, в эпицентре площадь этой области на поперечных срезах спинного мозга в опыте более чем в 3 раза меньше, чем в контроле (рис. 2А). Различие по данному показателю к 60 сут. эксперимента уменьшается в большинстве исследованных плоскостей, проходящих на различном расстоянии от эпицентра травмы, площадь области повреждения серого вещества в опыте сохраняется достоверно меньшей, чем в контроле. Эта тенденция прослеживается как в ростральном, так и в каудальном фрагментах (рис. 2Б).
На тех же сроках эксперимента наиболее выраженное уменьшение площади деструкции в опыте выявлено в белом веществе. Однако эти различия статистически значимы только в эпицентре травмы и в непосредственной близости от него (рис. 2В, Г).

Микрокисты формировались в первые сутки и к 5–7 сут. сливались, образуя патологические полости преимущественно в белом веществе. Ранее на данной экспериментальной модели нами отмечено увеличение суммарной площади полостей в ходе развития патологического процесса, что прослежено вплоть до 60 сут. эксперимента [5] . Обращает на себя внимание значительное увеличение этого показателя по мере приближения к эпицентру травмы, что в наибольшей мере проявляется в зонах 1 и 2.
Через 30 сут. после КТСМ на расстоянии 5 мм от эпицентра травмы в передних канатиках (зоны 1 и 2) у животных опытной группы выявлено существенное снижение суммарной площади патологических полостей, по сравнению с контрольной группой. Так, при трансплантации КОВ в зоне 1 каудального фрагмента этот показатель уменьшался в 8 раз (P [12] . К 60 сут. в опыте, т.е. при ведении КОВ, практически во всех зонах и особенно в боковых канатиках, чаще встречались миелиновые волокна небольшого диаметра и безмиелиновые волокна с незначительными структурными изменениями в виде редких областей повышенной электронной плотности миелина, некоторой его нечеткостью и незначительными участками расслоения, появления небольших вакуолей в периаксональном пространстве с редкими фрагментами внутренних мембран миелина или островков гомогенного материала (рис. 3Г).

На расстоянии 5 мм каудальнее эпицентра не выявлено достоверного преобладания количества миелиновых волокон в опытной группе животных. В этой группе сохраненные миелиновые волокна имели больший диаметр. В зонах 2 и 4 (левая сторона, соответственно передние и боковые канатики) количество сохраненных миелиновых волокон в группе животных с введением клеток меньше, чем в соответствующем контроле. Это уменьшение может быть следствием дополнительной травмы в ходе осуществления процедуры введения КОВ в данную точку.
Однако на расстоянии 3 мм от эпицентра травмы практически во всех исследованных областях белого вещества количество миелиновых волокон в опытной группе превышало их количество в контроле. В зоне 1 этот показатель при трансплантации клеток больше в 1,5 раза (р [14] . Будучи введенными в грудной отдел интактного спинного мозга иммунодефицитных крыс, КОВ к 7 сут. мигрируют на расстояние не более 1 мм. При этом в условиях гемисекции спинного мозга, на контралатеральной от места введения клеток стороне их способность к миграции уменьшается в 1,5–2 раза [8] . Это снижение миграционного потенциала трансплантируемых клеток может быть следствием формирования глиального рубца. Однако на модели передавливания дорсального отдела спинного мозга крысы показана миграция трансплантируемых КОВ на расстояние в 25 мм в условиях введения клеток через 2 нед. после травмы [7] , когда рубец уже сформирован. В наших экспериментах появление трансплантированных в спинной мозг КОВ на удалении от места инъекции может быть связано с их пассивным перемещением вследствие развития отека и напряжения ткани в области травматического повреждения. В отношении КОВ при их трансплантации в спинной мозг допускается возможность подобного неактивного перемещения [7] . В отношении способности к миграции трансплантированных в спинной мозг КОВ наши данные более близки результатам исследования Li et al. [13] , полученным на модели бокового амиотрофического склероза у трансгенных по супероксиддисмутазе SOD1(G93A) крыс при трансплантации КОВ в область дорсальных канатиков. Авторы этой работы показали возможность миграции трансплантированных КОВ в спинном мозге реципиента на расстояние 4,2 мм при их выживании в течение более 4 нед. При этом зарегистрировано существенное снижение гибели мотонейронов и стимулирование процесса ремиелинизации.
При травме спинного мозга, при которой область повреждения достаточно обширна, миграционный потенциал трансплантируемых клеток представляется крайне важным для нейрорегенерации. Он особенно значим для сдерживания процесса дегенерации миелиновых волокон и для стимулирования их ремиелинизации на всем протяжении области деструкции, начиная от эпицентра травмы и заканчивая зоной сохраненной ткани с интактными волокнами.
Выявленное нами уменьшение патологической кавитации при трансплантации КОВ человека в спинной мозг крысы согласуется с результатами трансплантации подобных клеток от человека, приматов и грызунов в спинной мозг крысы на моделях контузионной травмы [9] , фотохимического повреждения [17] , компрессии дорсо-латерального отдела [16] и полной перерезки [10, 11] .
Представляется достаточно вероятным, что КОВ человека, благодаря своей способности продуцировать нейротрофические факторы, молекулы адгезии и внеклеточного матрикса, а также стимулировать миграцию шванновских клеток в очаг повреждения спинного мозга, создают благоприятные условия для ремиелинизации и восстановления функции.
Механизм позитивного влияния трансплантации КОВ при травме спинного мозга остается неясным. В последнее время высказывается предположение о проявлении со стороны КОВ свойств иммунокомпетентных клеток и их способности модулировать выраженность процесса воспаления и вторичного повреждения в области травмы спинного мозга [9, 11] .
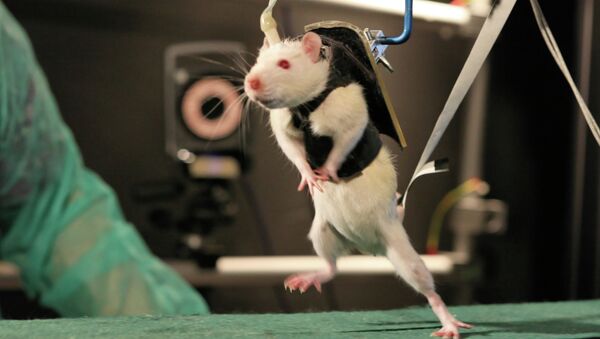
МОСКВА, 24 окт – РИА Новости. Нейрофизиологи из Петербурга и Цюриха разработали новую методику стимуляции позвоночника после травмы спинного мозга, которая позволила почти полностью вернуть подвижность парализованным крысам, говорится в статье, опубликованной в журнале Nature Medicine.
"Для начала клинических испытаний требуется соблюсти все этические и юридические нормы, конечно, необходимо согласие пациентов. Могу сказать, что людей, страдающих параличом, которые бы согласились участвовать в клинических испытаниях, достаточно много. Пациенты активно пишут, сообщают, что они многое перепробовали и им ничего не помогает. Внимание СМИ значительно повысило интерес к нашему методу", — заявил Павел Мусиенко из Института физиологии РАН в Санкт-Петербурге, чьи слова приводит пресс-служба Российского научного фонда.
Повреждение позвоночника в большинстве случаев приводит к частичному или полному параличу конечностей в зависимости от места травмы. На сегодняшний день ученые разрабатывают несколько методов лечения таких травм. В большинстве случаев биологи пытаются использовать стволовые клетки для восстановления соединения между частями спинного мозга. Существуют и принципиально иные методы — подключение конечностей к головному мозгу при помощи электродов.
Группа биологов под руководством Грегуара Куртина (Gregoire Courtine) из университета Цюриха (Швейцария) несколько лет назад разработала оригинальную методику, позволяющую вернуть свободу движения парализованным крысам без хирургического вмешательства и инъекций стволовых клеток.
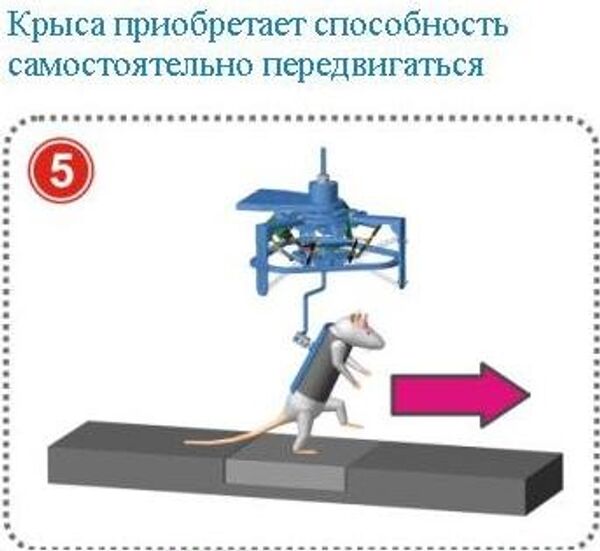
Куртин и его коллеги, в том числе Мусиенко и ряд других российских ученых, обратили внимание на то, что даже при самых серьезных повреждениях спинного мозга часть нервных волокон остается нетронутыми. Данные цепочки нейронов не задействованы в работе двигательной системы организма, однако их можно переключить на новую задачу. Электростимуляция этих нейронов и особые тренировки в специальном "экзоскелете" позволили крысам почти полностью восстановить подвижность своих ног после частичного разрезания их позвоночника.
Проблема заключается в том, что подобные методики стимуляции пока нельзя использовать для восстановления подвижности людям или животным, которые находятся в параличе очень длительное время, или тем людям, которые парализованы лишь частично.
Мусиенко и его коллеги сделали большой шаг к решению этой проблемы, создав особые электродные матрицы и технологии их имплантации в спинной мозг, которые позволили команде Куртина проследить за тем, какие нервные клетки спинного мозга "включаются" во время исполнения различных движений задними ногами крысы и как на их сигналы реагируют мышцы. Ученые провели подобные опыты как на здоровых крысах, так и на тех животных, которым они вернули способность ходить после раздробления и сращивания спинного мозга через 9 недель после травмы.

Технологии имплантации и алгоритм электростимуляции спинного мозга, разработанные нейрофизиологами на базе этих наблюдений, помогут ученым разобраться, как именно "работает" восстановление спинного мозга при помощи электростимуляции. Кроме того, они смогут понять, как можно "исправить" точечные дефекты в его работе, в том числе односторонний паралич конечностей, дефекты походки и прочие вещи, связанные с травмами нервной системы, а также лечить паралич через несколько месяцев или лет после его развития.
Как отмечает российский нейрофизиолог, перед внедрением нового метода в клиническую практику предстоит большая работа по тестированию разработанного подхода на более крупных животных – кошках и, возможно, обезьянах. При адекватном финансировании и расширении участников научной группы, как считает Мусиенко, данная методика должна скоро попасть в клиническую практику.
Кандидат медицинских наук Павел Мусиенко, Институт физиологии им. И. П. Павлова РАН (Санкт-Петербург).
Можно ли использовать эти нейронные системы спинного мозга для восстановления двигательных функций у людей, парализованных в результате спинальной травмы?
При травме спинного мозга пациент утрачивает двигательные функции потому, что нарушается или полностью разрывается связь между головным мозгом и телом: сигнал не проходит, и ниже места повреждения не происходит активации двигательных нейронов. Так, травма шейного отдела спинного мозга может привести к параличу и потере функций рук и ног, так называемой тетраплегии, а травма грудного отдела — к параплегии, обездвиживанию только нижних конечностей: как если бы подразделения некоей армии, сами по себе функциональные и боеспособные, оказались отрезаны от штаба и прекратили получать команды.
Можно ли это предотвратить? Ответ, который даёт современная нейрофизиология, обнадёживает.
На нейронных сетях даже повреждённого спинного мозга остаются рецепторы, способные этот сигнал воспринимать. Следовательно, можно попытаться активировать спинальные сети с помощью соответствующих моноаминергических препаратов, вводя их в нервную ткань спинного мозга извне.
Это обстоятельство легло в основу экспериментов по химической стимуляции.
Чтобы ответить на этот вопрос, мы попробовали сочетать химическую нейростимуляцию с электрической. Ещё в 2007 году совместные эксперименты российских и американских нейрофизиологов показали, что если на поверхность спинного мозга крысы поместить электроды, то электрическое поле вокруг активного электрода может возбуждать проводящие спинальные структуры. Поскольку в эксперименте использовались очень небольшие токи, в первую очередь активировались наиболее возбудимые ткани вблизи электрода: толстые проводящие волокна задних спинномозговых корешков, передающие сенсорную информацию от рецепторов тканей конечностей к нейронам спинного мозга. Такая электростимуляция позволяла активизировать двигательные функции у спинальных животных.
Специальный робот даёт крысе возможность свободно передвигаться, при необходимости поддерживая и контролируя её перемещения по трём направлениям (x, y, z). Причём сила воздействия по различным осям может меняться в зависимости от экспериментальной задачи и собственных двигательных способностей животного. В робототехнической установке использованы мягкие эластичные приводы и спирали, которые устраняют инерционное влияние силовых воздействий на живой объект. Это даёт возможность применять установку в поведенческих опытах. Робот опробован на экспериментальной модели парализованной крысы с повреждениями противоположных половин спинного мозга на уровне разных спинномозговых сегментов. Связь между головным и спинным мозгом была полностью прервана, однако сохранялась возможность прорастания новых нервных волокон между левой и правой частями спинного мозга. (Данная модель имеет сходство с повреждениями спинного мозга у людей, которые чаще всего являются анатомически неполными.) Комбинация тренировки в робототехнической системе с многокомпонентной химической и электрической стимуляцией спинного мозга позволила таким животным ходить вперёд по прямой, переступать через препятствия и даже подниматься по лестнице. У крыс появились новые межнейронные связи в области повреждения спинного мозга и восстановился произвольный контроль движений.
Так родилась идея электрохимических нейропротезов для имплантации в спинной мозг и управления спинальными сетями. Через специальные каналы имплантата можно вводить лекарства, которые действуют на соответствующие рецепторы и имитируют модулирующий нервный сигнал, прерванный после травмы. Матрица электродов стимулирует сенсорные входы разных сегментов и через них активирует отдельные популяции нейронов, чтобы таким образом вызвать определённые движения.
Стандартный клинический подход лечения пациентов с тяжёлыми спинальными травмами направлен на предотвращение дальнейших вторичных повреждений нервной системы, соматических осложнений паралича, на психологическую помощь парализованным больным и обучение их использованию оставшихся функций. Восстановительная терапия утраченных моторных навыков при тяжёлых повреждениях спинного мозга не только возможна, но и необходима.
Экспериментальные и клинические исследования показывают высокую эффективность стимуляции спинного мозга и тренировки после тяжёлой вертеброспинальной травмы. Хотя уже получены успешные результаты стимуляции спинного мозга у пациентов с сильнейшим параличом, основная часть исследовательской работы ещё впереди. Кроме того, предстоит разработать спинальные имплантаты для электрохимической стимуляции и найти оптимальные алгоритмы их использования. На всё это сейчас направлены активные усилия ведущих лабораторий мира. Сотни самостоятельных и межлабораторных исследовательских проектов посвящены достижению этих целей. Остаётся надеяться, что в результате совместных усилий мировых научных центров в общепринятые клинические стандарты войдут более эффективные методы лечения парализованных больных.
Читайте также:


