Рак головы и шеи статья
К опухолям головы и шеи относят онкологические заболевания носа, рта, гортани, глотки, слюнных желез, придаточных пазух. Опухоли эндокринной, лимфатической, центральной нервной системы и глаз в эту группу не входят.
Доля опухолевых образований области головы и шеи составляет около 20% онкологической заболеваемости. Часто эти опухоли оказываются очень агрессивны: они быстро растут, дают множественные метастазы и с трудом поддаются лечению. Для того, чтобы успешно справляться с опухолями головы и шеи, онкологи взаимодействуют с узкими специалистами, в частности, с отоларингологами, стоматологами и дерматологами.

По расположению различают опухоли губ, слизистой оболочки и полости рта, языка, слюнных желез, глотки, гортани, носа, околоносовых пазух.
Опухоли головы и шеи могут иметь соединительнотканное, эпителиальное, нейрогенное происхождение. По степени зрелости клеток среди них выделяют высокодифференцированные и незрелые, последние хуже поддаются лечению и ухудшают общий прогноз.
Спровоцировать развитие опухолей головы и шеи могут различные причины. Вот лишь некоторые из них:
- злоупотребление алкоголем;
- курение и нюхательно-жевательный табак;
- употребление спиртосодержащих жидкостей для ополаскивания полости рта;
- некоторые вирусы (вирус Эпштейна-Барр, вирус папилломы человека и др.);
- профессиональные вредности (контакт с древесной и текстильной пылью, сажей, краской, металлом и др.);
- радиоактивное излучение;
- регулярное употребление слишком горячей пищи.
Чаще всего новообразования головы и шеи возникают у пациентов в возрасте старше 50 лет. Клинические проявления опухолей данной группы в зависимости от расположения и стадии могут быть очень разнообразными.
Рак губы
До 95% случаев рака губы встречается у мужчин, типичным местом локализации опухоли является нижняя губа. С точки зрения гистологии, злокачественные опухоли губы обычно представляют собой плоскоклеточный рак. Ему чаще всего предшествуют предраковые состояния — хронические трещины, ограниченный гиперкератоз, бородавчатый предрак и др.
Для рака губы на разных стадиях развития характерны местные изменения в виде вдавления или болезненной эрозии, покрытой корочками. Со временем рак губы захватывает все большую площадь и может изъязвляться. Благодаря особенностям расположения рак губы легко распознается на ранних стадиях, поэтому хорошо поддается лечению.
Рак полости рта
До 50% злокачественных опухолей полости рта приходится на рак языка, еще 20% случаев составляет рак дна ротовой полости. Опухоль часто развивается на месте лейкоплакии (характерных роговых пластинок), гиперкератической красной волчанки или красного плоского лишая.
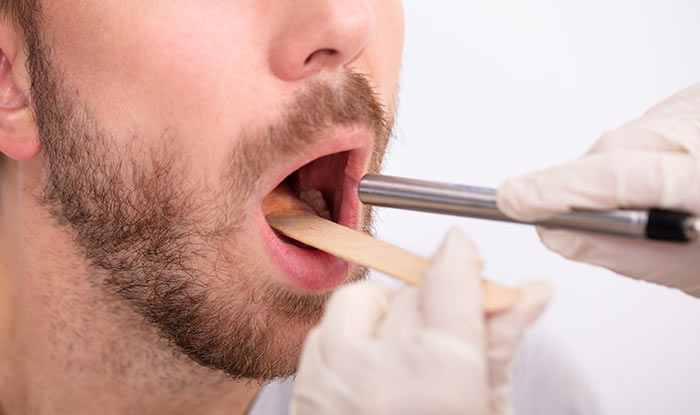
Внешне рак полости рта может иметь вид язвы или инфильтрата (уплотнения). В ряде случаев опухоль выступает над поверхностью слизистой. По строению ткани среди онкологических заболеваний полости рта преобладает плоскоклеточный рак, реже встречается аденокарцинома. Для рака полости рта характерно быстрое и незаметное прорастание в здоровые окружающие ткани и метастазирование в региональные лимфоузлы.
Уже на ранних стадиях рака ротовой полости пациентов беспокоят боль и неприятные ощущения, позднее присоединяются затруднения при глотании и разговоре, припухлость, язвочки, кровотечения из ротовой полости. По мере роста опухоли все симптомы усиливаются, что и становится поводом для обращения к врачу.
Рак слюнных желез
В структуре злокачественных опухолей головы и шеи рак слюнных желез составляет 3–5%. Преимущественно поражаются крупные околоушные железы, а опухоли малых слюнных желез в основном локализуются на нёбе. В слюнных железах можно обнаружить следующие формы:
- мукоэпидермоидный рак;
- ацинозно-клеточный рак;
- цилиндрома;
- аденокарцинома.
Рак слюнных желез дает метастазы в близлежащие лимфатические узлы, иногда — в легкие и кости. Клинически он протекает безболезненно, при осмотре можно обнаружить лишь уплотнение. При прорастании в соседние ткани рак слюнных желез вызывает парез лицевого нерва.
Рак гортани и глотки
Рак гортани в структуре всех злокачественных опухолей составляет около 2%. Наиболее частые его морфологические варианты- плоскоклеточный рак и аденокарцинома. Опухоль может прорастать в стенки органа или имеет вид бугристых разрастаний на широком основании. Рак верхнего отдела гортани считается очень опасным, при поражении голосовых связок прогноз благоприятнее, так как опухоль в этом случае растет медленнее и редко дает метастазы.
Пациенты с раком гортани долгое время жалуются на першение в горле, ощущение инородного тела. При поражении надгортанника рано появляются боли при глотании, если опухоль возникла в области голосовых связок, у больного может наблюдаться охриплость голоса вплоть до полного его исчезновения.
На рак глотки приходится до 12% опухолей головы и шеи. Для него характерны ранние метастазы в лимфоузлы. Рак гортани развивается в труднодоступном для обозрения месте, часто без каких-либо симптомов, поэтому, как правило, обнаруживается на поздних стадиях, когда у пациента уже затрудняется носовое дыхание, ухудшается слух, появляется гнусавость голоса.
Диагностика и лечение
Многие опухоли головы и шеи можно обнаружить при простом осмотре. Если поражается носовая полость, пазухи, гортань или глотка, для осмотра используют специальные инструменты с зеркалами, а также эндоскопическое оборудование. При пальпации можно обнаружить увеличенные лимфатические узлы, а также саму опухоль в виде уплотнения, подвижного или спаянного с соседними тканями.
Новообразования мягких тканей, околоушных слюнных желез легко обнаружить при помощи ультразвукового исследования. Большую роль в детализации строения опухолей головы и шеи играют рентгенологические методы исследования — компьютерная и магнитно-резонансная томография. Окончательный диагноз позволяет установить биопсия ткани опухоли и ее гистологическое изучение.

Радикальный способ лечения опухолей головы и шеи — хирургическое удаление новообразования и региональных лимфатических узлов. Для опухолей первой стадии бывает достаточно только операции, на второй стадии хирургическое лечение комбинируют с радиологическим. Иногда курс лучевой терапии назначают перед оперативным вмешательством для уменьшения размеров опухоли и предупреждения появления метастазов. Облучению в обязательном порядке подвергаются также расположенные в непосредственной близости от опухоли лимфатические узлы.
При раннем обнаружении опухоли в носовой полости, синусах, глотке применяют эндоскопический доступ, если образование небольшое, ограничено капсулой и находится на поверхности слизистой, может быть использована крио- или лазерная деструкция,фотодинамическая терапия. Это наиболее щадящие способы лечения. После удаления опухоли из-за особенностей ее расположения и функционирования пациентам часто необходима пластика в области шеи и лица.
Комбинацию лучевой и химиотерапии применяют с паллиативной целью, когда опухоль невозможно удалить полностью.
Обычному человеку, далекому от медицины, может показаться пугающим многообразие болезней, но не стоит забывать о том, что заболевания, выявленные на ранних стадиях или, другими словами, вовремя, поддаются успешному лечению в своем большинстве; и впоследствии можно продолжать жить и работать на благо своей семьи и общества в целом без ограничений по состоянию здоровья.
Давайте рассмотрим еще одно онкозаболевание, успешно излечимое при выявлении на ранних стадиях развития: это рак головы и шеи.
К раку головы и шеи относят злокачественные новообразования носа, гортани, глотки, придаточных пазух и слюнных желез. Направление развития рака головы и шеи отличается и зависит от места расположения опухоли. Например, раковые заболевания, которые возникают в задней части языка, ведут себя совершенно иначе, чем рак голосовых связок, хотя расположены они буквально в нескольких сантиметрах друг от друга. Таким образом, не существует общей, схожей картины заболевания и прогрессирования.
Виды рака головы и шеи
Рак головы и шеи подразделяют на пять разных видов:
Злокачественные новообразования гортани. Гортань расположена в верхней части трахеи и играет важную роль в дыхании, речи и процессе глотания человека.
Злокачественные новообразования полости носа и околоносовых пазух. Носовая полость представляет собой пространство позади носа, которое проходит воздух на своем пути к горлу. Околоносовыми пазухами называют небольшие полости, окружающие носовую полость.
Злокачественные новообразования носоглотки. Носоглоткой называют воздушный канал в верхней части горла, позади носа.
Злокачественные новообразования полости рта и ротоглотки. Полость рта включает в себя рот и язык. Ротоглотка располагается в середине горла, от миндалин и до начала голосовых связок.
Злокачественные новообразования слюнных желез. Слюнными железами называют ткань, которая производит слюну, необходимую для увлажнения и первичной обработки поступающей пищи.
В нашей стране, по статистике, количество злокачественных новообразований в области головы и шеи составляет примерно около 20% всех случаев онкозаболеваний человека.
Наиболее распространенным видом рака, возникающим в этой области, является так называемый плоскоклеточный рак, который возникает из эпителиальных клеток, выстилающих внутреннюю поверхность носа, рта и горла.
Факторы риска возникновения рака головы и шеи
Плоскоклеточный рак этого типа чаще всего развивается на фоне длительного курения или контакта с вирусом папилломы человека.
По научным данным, курение табака повышает вероятность рака головы и шеи в 15 раз!
Также доказано, что одновременное употребление табака и алкоголя гораздо больше увеличивает вероятность развития злокачественных опухолей, чем их раздельное потребление. Воздействие окружающей среды, в виде солнечных лучей также может привести к развитию рака головы и шеи в виде меланомы или рака губ.
Злокачественные новообразования на внутренней поверхности носа, рта и горла составляют большую часть случаев заболеваний рака головы и шеи. У мужчин количество случаев рака ротовой полости приблизительно в два раза больше, чем у женщин.
Заболеваемость раком щитовидной железы, который также относится к рассматриваемой нами группе, существенно выросла, согласно статистике, за последние двадцать лет, и у мужчин, и у женщин. Его два наиболее распространенных вида – папиллярный рак и фолликулярная карцинома. Смертность от рака щитовидной железы низка по сравнению с другими формами рака головы и шеи. Рак щитовидной железы чаще встречается у женщин, чем у мужчин.
Злокачественные опухоли носа и носовых пазух встречаются крайне редко.
Меньшую, но также заслуживающую пристального внимания часть случаев онкозаболеваний этой области составляют новообразования слюнных желез, а также лимфомы и саркомы.
Распространение рака головы и шеи
Опухоли, возникающие в области головы и шеи, обычно распространяются в четырех основных направлениях:
- увеличение площади первичного новообразования с постепенным захватом прилегающих областей;
- распространение по лимфатическим каналам с захватом попутных лимфоузлов;
- периневральное распространение, то есть распространение опухоли вдоль нервов в другие области головы и шеи, отстоящие на некоторое расстояние от очага зарождения раковой опухоли;
- через кровеносные сосуды человека, в другие, отдаленные участки организма.
При раке головы и шеи нередко поражаются прилегающие лимфоузлы.
Вероятность распространения злокачественных новообразований на другие органы человека существенно возрастает, если поражению раком подверглись лимфоузлы в нижней части шеи. Это связано с тем, что большинство лимфоузлов человека расположены вдоль крупных кровеносных сосудов.
Симптомы рака головы и шеи
Диагноз рака головы и шеи чаще всего ставит врач-стоматолог, на плановом приеме, если пациент жалуется на: незаживающую болячку во рту, охриплость (изменение голоса), комок в горле, опухоль в области головы или шеи, постоянные боли в горле, плохой запах изо рта, не исчезающий после проведения гигиенических процедур, постоянную или периодическую заложенность носа, частые кровотечения из носа или необычные выделения из него, затрудненное дыхание, раздвоение в глазах, нечеткое зрение, онемение или слабость участка тела в области головы и шеи, боль в ухе или в челюсти, болезненное и затрудненное жевание, глотание, наличие крови в слюне или мокроте, кашле, необъяснимую потерю веса, постоянное чувство усталости, выпадение зубов.
Диагностика рака головы и шеи
Диагноз рака головы и шеи может быть поставлен при плановом обследовании.
При подозрении на рак головы и шеи для более точной диагностики врач может дополнительно назначить следующие вида исследований:
- рентгенологическое обследование.
- компьютерная томография. Позволяет визуально выявить злокачественное новообразование.
- УЗИ.
- Магнитно-резонансная томография (МРТ). Позволяет получить детальное изображение мягких тканей человека.
В некоторых случаях обязательно проводится биопсия ткани опухоли с исследованием материала в лаборатории.
Лечение рака головы и шеи
Для лечения рака головы и шеи используют лучевую терапию, хирургическое удаление злокачественной опухоли, химиотерапию.
Основными способами лечения являются лучевая терапия или операция. Также часто оба этих метода сочетают. Химиотерапия чаще всего используется как дополнение. Оптимальное сочетание этих трех методов лечения рака зависит от локализации опухоли. То есть, в зависимости от местоположения новообразования лечащий врач назначает разные пропорции лучевой терапии, химиотерапии и хирургического вмешательства.
Так, на ранних стадиях заболевания раком головы и шеи обычно назначают только один вид лечения – лучевую терапию, или хирургическое вмешательство. Пациенты, у которых рак прошел раннюю стадию, в качестве лечения получают одновременно лучевую и химиотерапию.
Также, в некоторых случаях, пациентов лечат хирургическим путем, с последующим назначением лучевой или химиотерапии. Операция по удалению пораженных лимфоузлов в области шеи (так называемое шейное рассечение) может понадобиться, если количество пораженных лимфоузлов невелико, или если рак в шейных лимфоузлах не был до конца устранен при помощи химио- или лучевой терапии.
По последним научным данным, установлено, что одновременное применение химиотерапии и лучевой терапии имеет гораздо больший положительный эффект, чем их раздельное, поочередное применение для лечения рака головы и шеи.
Химиотерапия представляет собой введение различных лекарственных средств против рака в организм человека, обычно с помощью внутривенного капельного вливания. Химиотерапия для пациентов с раком головы и шеи может быть назначена в различных дозах, например в низкой суточной дозе, умеренно низкой недельной дозе или высокой дозе через каждые три — четыре недели.
Лучевая терапия пациентов с раком головы и шеи включает в себя облучение места расположения опухоли пучком рентгеновских лучей или протонов. Высокоэнергетический пучок генерируется за пределами тела пациента, с помощью линейного ускорителя фотонов, рентгеновского циклотрона или синхротрона для пучка протонов. Лучевая терапия призвана локализовать злокачественную опухоль, уменьшить очаг ее распространения. Рентгеновское излучение способно уничтожать клетки опухоли, и в то же время тщательное планирование и расчет высокоточной лучевой терапии позволяет свести к минимуму уничтожение прилежащих к опухоли здоровых тканей.
Профилактика рака головы и шеи
В качестве профилактики рака головы и шеи, медики рекомендуют вакцинацию против вируса папилломы человека, занятия спортом или фитнесом, умеренную солнечную экспозицию, а также ограничение приема спиртных напитков и отказ от курения.
Введение. В настоящее время отсутствуют методы лечения рецидивов плоскоклеточного рака головы и шеи, достоверно увеличивающие общую выживаемость (ОВ) пациентов, что обусловливает актуальность данной проблемы.
Цель исследования – анализ результатов лечения пациентов с рецидивами плоскоклеточного рака головы и шеи, оценка влияния факторов риска рецидива и различных вариантов лечения рецидива на показатели ОВ.
Материалы и методы. Проанализированы данные 182 больных с рецидивами плоскоклеточного рака гортани, полости рта и языка, находившихся на лечении в Челябинском областном клиническом центре онкологии и ядерной медицины в период с 2012 по 2016 г. В 1-ю группу вошли 66 пациентов, подвергшихся хирургическому лечению, во 2-ю – 25 пациентов, прошедших курс повторной лучевой терапии, в 3-ю – 46 пациентов, у которых проведена полихимиотерапия, в 4-ю – 9 пациентов, лечение которых было комбинированным, в 5-ю – 36 пациентов, которым специальное лечение не было назначено ввиду низкого индекса Karnofsky (
Введение. По рекомендациям российских и международных профессиональных ассоциаций лечение гермином можно начинать без обязательной гистологической верификации благодаря наличию биохимических опухолевых маркеров. Однако при первичных герминомах головного мозга уровень этих маркеров остается в пределах нормы, поэтому гистологическая верификация становится необходима. Стереотаксическая биопсия и биопсия с применением транскраниальных доступов в некоторых случаях связаны с риском повреждения критически важных структур. Сейчас провести биопсию и даже тотально удалить опухоль селлярной и параселлярной локализации возможно с использованием эндоскопического эндоназального доступа.
Цель исследования – продемонстрировать возможность использования эндоскопического транссфеноидального доступа для выполнения хирургического вмешательства в объеме от биопсии до тотального удаления первичных гермином хиазмально-селлярной локализации.
Результаты. Объем хирургического вмешательства варьировал от биопсии (n = 4) до частичного (n = 5) и тотального (n = 4) удаления опухоли. Во всех случаях диагноз был гистологически верифицирован. Ни у одного из пациентов в послеоперационном периоде не наблюдалась ликворея и / или менингит, что позволяет оценить эндоскопическое вмешательство как безопасное и эффективное.
Заключение. Использование эндоскопического эндоназального доступа для гистологической верификации и удаления гермином хиазмально-селлярной области безопасно и эффективно.
Цель исследования – проанализировать результаты комбинированного противоопухолевого лечения, включающего глоссэктомию, по поводу местно-распространенного и рецидивного плоскоклеточного орофарингеального рака.
Материалы и методы. Проведен ретроспективный анализ результатов комбинированного и комплексного противоопухолевого лечения 19 пациентов, прошедших лечение в Нижегородском областном клиническом онкологическом диспансере с 2009 по 2019 г. В ходе операции у всех пациентов осуществлена сегментарная резекция нижней челюсти в связи с массивной инвазией опухоли в надкостницу, для реконструкции дефекта после тотальной глоссэктомии применяли пекторальный кожно-мышечный лоскут. Ввиду широкой местной распространенности опухоли выполнено фасциально-футлярное иссечение клетчатки шеи (n = 7) или радикальная шейная лимфодиссекция (n = 12). В ходе профилактической операции у 2 пациентов обнаружены не выявленные до операции метастазы в 1 лимфатическом узле шеи.
Результаты. Местные гнойно-некротические послеоперационные осложнения зарегистрированы у 11 пациентов. Отмечено, что при выполнении операции у пациентов, не проходивших лучевую терапию, осложнения развились в меньшем числе случаев (n = 4), а степень их тяжести была ниже: I степени – у 3 больных, III степени – у 1. Если операции предшествовала лучевая терапия, гнойно-некротические осложнения развивались чаще – в 7 случаях, при этом они были более тяжелыми: I степени – у 2 пациентов, II степени – у 1, III степени – у 4. Летальность составила: 30-дневная – 10,5 %, 60-дневная – 21 %, 90-дневная – 37 %. Причинами смерти стали осложнение гастростомии – профузное кровотечение из стенки желудка (n = 1), острый психоз, осложненный отеком головного мозга (n = 1), нарастания сердечной недостаточности (n = 1), некроз передней брюшной стенки и кахексия, развившиеся после гастростомии (n = 1), продолженный опухолевый рост между курсами химиотерапии (n = 3). Живы более 90 дней после операции 12 пациентов, более 2 лет – 3 пациента. Ввиду невозможности глотания большинству пациентов вводили назогастральный зонд, так как одномоментная гастростомия увеличивает продолжительность травматичной операции и отягощает послеоперационный период.
Заключение. При проведении многокомпонентной операции после лучевой терапии местные гнойно-некротические послеоперационные осложнения регистрируются чаще, чем при отсутствии лучевой терапии. Высокая летальность в первые 90 дней после операции (n = 7) из-за местной распространенности обусловлена в целом тяжелым состоянием больных раком на поздней стадии и наличием сопутствующих заболеваний, однако обоснованным представляется отказ от гастростомии в пользу введения назогастрального зонда, поскольку летальные исходы в раннем послеоперационном периоде могут быть обусловлены связанными с ней осложнениями.
Введение. Пациенты с опухолями головы и шеи зачастую нуждаются в трахеостомии. Данная манипуляция – сложное хирургическое пособие, несущее риск осложнений, в том числе опасных для жизни.
Цель исследования – оценить результаты выполнения пункционной трахеостомии с использованием нового устройства SafeTrach.
Материалы и методы. В исследование включен 21 пациент. У всех пациентов была выполнена трахеостомия с использованием устройства SafeTrach.
Результаты. Среднее время, затрачиваемое на выполнение процедуры, составило 11,8 ± 3,4 мин и не коррелировало с индексом массы тела и видом предшествующего лечения (r = 0,08, p = 0,7 и r = 0,08, p = 0,73 соответственно). Из всех возможных осложнений трахеостомии лишь в 1 (4,7 %) случае развилось кровотечение в послеоперационном периоде.
Заключение. Описанная методика объединяет в себя все преимущества открытой и пункционной трахеостомии, характеризуется простотой выполнения, не требует эндоскопического контроля, что указывает на целесообразность ее широкого внедрения.
Цель исследования – изучение непосредственных и отдаленных результатов использования свободного лучевого лоскута для замещения сложных дефектов при комбинированном и комплексном лечении больных местно-распространенным плоскоклеточным раком слизистой оболочки полости рта.
Материалы и методы. В отделении опухолей головы и шеи Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина в 2010–2018 гг. у 28 больных местно-распространенным плоскоклеточным раком слизистой оболочки полости рта (20 женщин и 8 мужчин в возрасте от 23 лет до 71 года) выполнено хирургическое удаление опухоли с одномоментной пластической реконструкцией дефекта свободным реваскуляризированным лучевым лоскутом. У 10 пациентов был рак слизистой оболочки щеки, у 8 – языка, у 6 – дна полости рта, у 2 – ретромолярной области, у 1 – твердого неба, у 1 – альвеолярного отростка нижней челюсти. Первичные формы рака были у 17 больных, рецидивные – у 4, остаточные (после лучевого или химиолучевого лечения) – у 7.
Результаты. Полное приживление лучевого лоскута наблюдалось в 96,4 % случаев. При послеоперационном гистологическом исследовании установлено, что края резекции во всех случаях были свободными от опухоли. В послеоперационном периоде возникли следующие осложнения: полный некроз лоскута – у 1 пациента с тяжелыми сопутствующими заболеваниями, краевой некроз лоскута – у 2 пациентов (в обоих случаях раны, возникшие после отторжения некротических тканей, зажили вторичным натяжением), тромбоз суральных вен голеней – у 1 пациента, кровотечение из острой язвы желудка на 6-е сутки после операции – у 1 пациента, при этом экстренный гемостаз был выполнен эндоскопическим методом. Летальных исходов не зарегистрировано. Длительность послеоперационного периода составила в среднем 14 дней. При последующем наблюдении пациентов рецидивы опухоли в полости рта возникли у 4 (14,3 %) больных, рецидивы регионарных метастазов – у 2 (7,1 %). Отмечены хорошие эстетические и функциональные результаты. Адекватное восстановление функций дыхания, жевания, глотания и речи позволило обеспечить полноценную реабилитацию пациентов. Лучевой лоскут во всех случаях был хорошо адаптирован к органам полости рта и соответствовал по толщине и консистенции окружающим тканям.
Заключение. Использование свободного лучевого лоскута позволяет успешно выполнять реконструкцию обширных и сложных дефектов после хирургического удаления местно-распространенных первичных и рецидивных форм плоскоклеточного рака слизистой оболочки полости рта различной локализации. Благодаря хорошим регенераторным возможностям лоскута дооперационная лучевая терапия не влияет на частоту местных осложнений. Наблюдается полноценное восстановление жизненно важных функций полости рта, хорошие эстетические и функциональные результаты.
Введение. Внедрение в клиническую практику ингибиторов тирозинкиназы позволило улучшить результаты лечения пациентов с радиойодрезистентным дифференцированным раком щитовидной железы (РЙР ДРЩЖ). В качестве препарата 1-й линии у данной категории больных рекомендован ленватиниб.
Цель исследования – анализ обобщенного клинического опыта применения ленватиниба у пациентов с РЙР ДРЩЖ в Российской Федерации.
Материалы и методы. Проводился анализ данных, полученных в период с декабря 2015 г. по сентябрь 2019 г. в 18 медицинских учреждениях России. В исследование включены 77 клинических наблюдений гистологически верифицированного ДРЩЖ с доказанной резистентностью к терапии радиоактивным йодом и последующим прогрессированием опухоли по 1-й версии критериев RECIST (Response Evaluation Criteria in Solid Tumours 1.1, критерии оценки ответа солидных опухолей).
Результаты. Медиана выживаемости без прогрессирования у пациентов, включенных в анализ (n = 72), составила 26,1 мес. В подгруппе пациентов, ответивших на терапию (с полным и частичным ответом), выживаемость без прогрессирования достигла 36,2 мес, превысив аналогичный показатель, полученный при обновленном анализе в регистрационном исследовании SELECT (33,1 мес). При анализе безопасности терапии ленватинибом нежелательные явления были зарегистрированы у 87 % пациентов. При этом тяжелые нежелательные явления наблюдались лишь у 18,2 % пациентов. В 6,5 % случаев развитие нежелательных явлений стало причиной отмены препарата, в 74 % случаев доза ленватиниба была уменьшена.
Заключение. Полученные результаты свидетельствуют об эффективности и хорошей переносимости ленватиниба при РЙР ДРЩЖ в условиях клинической практики в Российской Федерации.
Введение. Базальноклеточный рак кожи (БКРК) составляет до 80 % всех немеланоцитарных форм рака кожи. В 97 % случаев БКР развивается на открытых участках кожи лица, особенно на границе носа и лба, в области крыльев носа, углов глаз и губ. Хирургическое лечение может приводить к грубым косметическим дефектам, в связи с чем все чаще врачи отдают предпочтение консервативным методам, особое место среди которых занимает локальная лекарственная терапия.
Цель исследования – оценить информативность биопсии сигнального лимфатического узла (ЛУ) при плоскоклеточном раке языка cT1–2N0.
Материалы и методы. В проспективное одноцентровое исследование включены 26 пациентов с морфологически верифицированным плоскоклеточным раком языка cT1–2 и отсутствием клинических и радиологических признаков метастатического поражения ЛУ шеи. У всех пациентов проведено радиоизотопное исследование для определения варианта лимфооттока от первичной опухоли и топографии сигнальных ЛУ. Информативность биопсии сигнальных ЛУ оценена при применении 2 диагностических моделей. При использовании 1-й диагностической модели сигнальными ЛУ считались все узлы, которые накапливают коллоид, меченный изотопом 99mTc. В рамках 2-й модели в качестве сигнальных ЛУ рассматривались только узлы, накапливающие радиоколлоид и находящиеся в непосредственной близости к первичной опухоли языка и / или связанные с первичной опухолью приносящими лимфатическими сосудами.
Результаты. При использовании 1-й диагностической модели чувствительность биопсии сигнальных ЛУ составила 66,6 % (95 % доверительный интервал (ДИ) 9,43–99,16 %), специфичность – 100 % (95 % ДИ 85,18–100,00 %), прогностическая ценность положительного результата – 100 %, прогностическая ценность отрицательного результата – 95,83 % (95 % ДИ 82,28–99,13 %), диагностическая точность – 96,15 % (95 % ДИ 80,36–99,90 %), а если вместе с сигнальными ЛУ были удалены все ЛУ, расположенные на одном с ними уровне, информативность биопсии приближалась к 100 %. При использовании 2-й диагностической модели чувствительность биопсии сигнальных ЛУ составила 33,3 % (95 % ДИ 0,84–90,57 %), специфичность – 100 % (95 % ДИ 85,18–100,00 %), прогностическая ценность положительного результата – 100 %, прогностическая ценность отрицательного результата – 92 % (95 % ДИ 83,78–96,24 %), диагностическая точность – 92,31 % (95 % ДИ 74,87–99,05 %).
Заключение. Данные об особенностях лимфооттока от первичной опухоли и топографии сигнальных ЛУ у пациентов с плоскоклеточным раком языка cT1–2N0M0 позволяют определить объем лимфодиссекции у каждого пациента индивидуально. В случае одностороннего лимфооттока односторонняя лимфодиссекция оправданна, а в случае двустороннего лимфооттока она сопряжена с достаточно высоким (до 10 %) риском метастатического поражения ЛУ на противоположной стороне шеи. Необходимо удаление всех ЛУ, накапливающих радиофармпрепарат, и регионарных ЛУ, расположенных на тех же уровнях.
Введение. Посттранскрипционные механизмы определяют биологическое течение и клинические проявления папиллярного рака щитовидной железы (ПРЩЖ). Последние исследования показывают, что увеличение содержания онкогенных микроРНК или снижение содержания онкосупрессорных микроРНК повышает агрессивность опухоли и коррелирует с неблагоприятным прогнозом лечения, что позволяет использовать их для индивидуализации лечения пациентов с ПРЩЖ. Цель исследования – сравнить уровень экспрессии 12 специфичных для ПРЩЖ микроРНК и частоту мутации V600E гена BRAF у пациентов с разным риском рецидива.
Материалы и методы. В исследование включены 175 пациентов с ПРЩЖ. Для количественного анализа экспрессии микроРНК использовали реакцию обратной транскрипции с последующей полимеразной цепной реакцией в реальном времени в фиксированных формалином парафиновых блоках. Вычисляли коэффициент корреляции между уровнем экспрессии 12 микроРНК и наличием мутации BRAF, различных клинико-анатомических особенностей ПРЩЖ, уровнем риска рецидива по системе стратификации риска (Risk Stratification System), разработанной Американской тиреоидологической ассоциацией (American Thyroid Association) в 2009 г.
Результаты. Экспрессия miR-146b, miR-221, miR-144, miR-451a и miR-7 коррелировала с такими признаками, как экстратиреоидный рост опухоли, больший размер, многоочаговость, метастазирование в лимфатические узлы и наличие отдаленных метастазов ПРЩЖ. Наиболее важно, что экспрессия miR-221, miR-144, miR-451a и miR-7 коррелировала с уровнями риска. Это позволяет предположить, что они могут служить критериями стратификации риска рецидива ПРЩЖ. Связи клинической картины ПРЩЖ и наличия мутации гена BRAF не установлено.
Заключение. Полученные в результате исследования данные будут способствовать индивидуальному подбору дооперационной лечебной тактики для пациентов с ПРЩЖ.
Цель исследования – оценка эффективности психологической помощи больным раком гортани после ларингэктомии.
Материалы и методы. В исследование включены 36 пациентов мужского пола в возрасте от 45 до 62 лет с морфологически верифицированным раком гортани II–IV стадий (Т3–4N0–2М0), проходивших лечение в отделении опухолей головы и шеи Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина в 2011–2016 гг. Больные случайным образом были поделены на 2 группы: в 1-ю вошли 14 пациентов, которые проходили только противоопухолевое лечение; во 2-ю – 22 пациента, которым дополнительно оказывалась психологическая помощь. Психическое состояние оценивали до лечения и через 6 мес после полного его завершения. На I этапе исследования были исключены 2 пациента 1-й группы и 1 пациент 2-й группы. Клинико-психологическое исследование проведено с использованием госпитальной шкалы тревоги и депрессии и опросника для определения выраженности психопатологической симптоматики (Simptom Check List-90 Revised).
Результаты. По результатам применения опросника через 6 мес после завершения лечения у больных обеих групп выявлена высокая выраженность психопатологической симптоматики: депрессивности, межличностной сензитивности, а также высокий индекс тяжести дистресса. Однако у больных, которым оказана психологическая помощь, уровень депрессии хотя и был выше, чем нормативные показатели, но оказался статистически значимо ниже, чем у больных, не получивших психологическую помощь. Аналогичные результаты дало применение госпитальной шкалы тревоги и депрессии: уровень депрессии у больных, которым оказана психологическая помощь, статистически значимо ниже, чем у больных без психологического сопровождения (8,3 ± 0,9 и 10,2 ± 0,6 балла
соответственно).
Заключение. Через 6 мес после завершения лечения у больных раком гортани, которым оказывалась психологическая помощь с использованием когнитивно-поведенческой психотерапии, статистически значимо снизился уровень депрессии в сравнении с таковым у больных, не получавших психологическую помощь.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


