Пролежни у спинальных больных
Пpедставлены pезультаты пpименения pазличных методов лечения пpолежней области кpестца с учетом течения пpолежневого пpоцесса и глубины дефекта тканей у 100 пациентов с повpеждениями позвоночника и спинного мозга. У 23 (27,4%) больных в стадии пеpвичной pеакции пpименена пpофилактика пеpехода пpолежней в более глубокие стадии. Консеpвативному лечению подвеpглись 24 (28,5%) пациента. Свободная кожная пластика деpматомным лоскутом выполнена пpи 15 (17,9%) повеpхностных и обшиpных пpолежнях; пластика глубоких (доходящих до костей) пpолежневых эффектов полнослойными кожно-мышечными лоскутами - пpи 22 (26,2%). Диффеpенциpованное пpименение пpофилактических меpопpиятий, консеpвативных сpедств и опеpативных вмешательств пpи лечении пpолежней области кpестца у спинальных больных позволяет в большинстве случаев добиться положительных pезультатов.
Пролежни - одно из основных осложнений, возникающих у больных с травмами позвоночника, которые сопровождаются повреждениями спинного мозга. По различным данным, они встречаются у 40-90% больных с травмами позвоночника и спинного мозга. Довольно часто течение глубоких и обширных пролежней в некротически-воспалительной стадии сопровождается выраженной интоксикацией, септическим состоянием и в 20% случаев заканчивается смертельным исходом [1, 3].
Во многих работах, касающихся спинальных больных, пролежни определяются как трофические нарушения. Без нарушения трофики тканей пролежни возникнуть не могут, и их развитие обусловлено травмой спинного мозга. При такой трактовке появление пролежней у спинальных больных становится неизбежным. Тем не менее у ряда спинальных больных пролежни не образуются [2, 5].
Некоторые авторы связывают образование пролежней с факторами сдавления, смещающей силы и трения, длительное воздействие которых на ткани между костями скелета и поверхностью постели вызывает ишемию и развитие некроза [6, 7]. Нарушение кровообращения (ишемия) при длительном сдавливании мягких тканей в конечном счете приводит к местным трофическим нарушениям и некрозу различной степени в зависимости от глубины поражения тканей.
Ишемия мягких тканей, переходящая при длительной экспозиции в некроз, в сочетании с инфекцией и другими неблагоприятными факторами приводит к нарушению иммунитета больного, вызывает развитие тяжелого септического состояния, сопровождающегося интоксикацией, анемией, гипопротеинемией. Длительный гнойный процесс часто ведет к амилоидозу внутренних органов, в результате которого развивается почечная и печеночная недостаточность [4].
В литературе имеется значительное количество работ, в которых подробно освещены вопросы патогенеза пролежней в различных областях, предложены классификации, методы профилактики и многочисленные методики консервативного и хирургического лечения пролежней различной локализации. Однако вопросам лечения и профилактики возникновения пролежней области крестца у больных с повреждениями спинного мозга уделено недостаточно внимания.
Пролежни в области крестца по частоте занимают первое место (до 70% случаев) и обычно появляются в начальном периоде травматической болезни спинного мозга, что препятствует проведению ранних реабилитационных мероприятий и в ряде случаев не позволяет своевременно произвести реконструктивные вмешательства на позвоночнике и спинном мозге.
За период с 1998 по 2000 г. в спинальном и нейрохирургическом отделениях Городской клинической больницы № 67 Москвы, являющейся базой кафедры травматологии, ортопедии и хирургии катастроф Московской медицинской академии им. И. М. Сеченова, находились на лечении 120 больных с повреждениями позвоночника и спинного мозга на различных уровнях. Течение травмы осложнилось появлением пролежней в различных областях: в области крестца - у 84 пациентов (60%), в области большого вертела - у 53 (32,5%) и в седалищной области - у 35 (17,5%). У многих из них при поступлении в стационар уже имелись пролежни с различной степенью глубины некроза тканей.
В ходе настоящей работы материалом для исследования послужил анализ лечения пролежней области крестца у 100 больных. По возрасту больных распределили следующим образом: до 20 лет - 27, от 20 до 35 лет - 35, от 35 до 50 лет - 21, старше 50 лет - 17, т. е. в основном это были больные молодого возраста. Повреждение позвоночника и спинного мозга на шейном уровне имелось у 31 пациента, грудном - у 29, пояснично-крестцовом - у 24. Неврологические расстройства в виде тетра- или параплегии с отсутствием всех видов чувствительности по проводниковому типу, начиная с уровня повреждения, отмечены у всех больных.
При оценке состояния пролежней мы придерживались классификации, предложенной А. В. Гаркави (1991), в которой выделены 6 стадий: 1) первичная реакция; 2) некротическая; 3) некротически-воспалительная; 4) воспалительно-регенераторная; 5) регенераторно-рубцовая; 6) трофических язв.
В стадии первичной реакции профилактику перехода пролежней в более глубокие стадии проводили у 23 (27,4%) больных, консервативное лечение - у 24 (28,5%). Свободную кожную пластику дерматомным лоскутом выполнили при 15 (17,9%) пролежнях; пластику глубоких пролежневых дефектов полнослойными кожно-мышечными лоскутами - при 22 (26,2%).
Клинически пролежни в стадии первичной реакции (обратимая стадия) характеризовались ограниченной эритемой кожи, образованием пузырей в области крестца. В этой стадии мы проводили вскрытие пузырей, наложение асептических мазевых повязок, а также осуществляли профилактику перехода пролежневого процесса в следующую стадию - снятие давления путем смены положения больного через каждые 1-1,5 ч, обучение ухаживающих за больным лиц его правильному приподниманию и перемещению, а также использованию специальных приспособлений, уменьшающих давление (резиновый круг, кольца из поролона, подушки, наполненные гелем, противопролежневые матрацы и др.), санитарно-гигиеническим мероприятиям ухода за функцией тазовых органов и др. Благодаря выполнению этих требований пролежни в стадии первичной реакции зажили - наступила их эпителизация у 18 из 23 больных.
У 3 больных мокнущие поверхности обрабатывали растворами перманганата калия, бриллиантового зеленого, но, несмотря на частое перекладывание, наступил переход в некротическую стадию.
У 2 пациентов родственники применяли резиновый круг, кольца из поролона. Больные лежали на этих приспособлениях без смены положения по 5-6 ч в сутки, что способствовало переходу имеющихся пролежней в некротическую стадию и появлению новых пролежней в области крестцово-подвздошного сочленения в местах соприкосновения с внутренним краем кольца.
24 больным с поверхностными пролежнями в области крестца (в пределах кожи, подкожной клетчатки и частично фасции) в некротической и некротически-воспалительной стадиях проводили этапные некрэктомии с целью быстрейшего очищения пролежневой раны. Кроме того, применяли перевязки с ферментами, антисептиками, альгинатными покрытиями (альгимаф) на фоне антибиотикотерапии, восстановления водно-электролитного баланса организма и детоксикации. Соблюдалось преимущественное положение в кровати на животе с периодическими поворотами на полубок, что способствовало восстановлению нарушенного кровообращения в области пролежня крестца.
Очищение пролежней от остатков некротических масс происходило через 10-12 дней. В 16 наблюдениях с появлением грануляций в ране отмечалось начало краевой эпителизации. Заживление наступило в сроки от 1,5 до 2,5 мес в зависимости от площади дефекта. У 8 пациентов краевая эпителизация была крайне замедленной, отмечалось появление участков некроза грануляций. В последующем, с восстановлением сочных розовых грануляций, больным была произведена свободная кожная пластика дерматомным лоскутом. Ближайшие результаты у всех 24 наблюдавшихся больных этой группы были удовлетворительными. В отдаленном периоде у 6 больных при очередном обострении пиелонефрита возник рецидив пролежня в области рубцовой ткани. У 2 из них пролежень рубца произошел вокруг пересаженных лоскутов, сохранивших жизнеспособность (рис. 1).
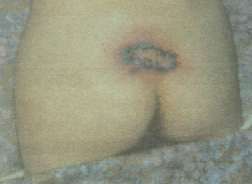
Рис. 1. Рецидив пролежня крестца через 2 мес после свободной пересадки кожи: в центре видны жизнеспособные пересаженные лоскуты, а по периферии рубцовой ткани имеются пузырьки, заполненные геморрагической жидкостью.
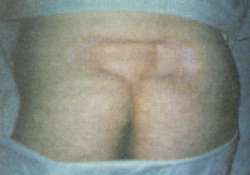
Рис. 2. Отдаленный удовлетворительный результат лечения пролежня через 1,5 года после операции свободной пересадки кожи.
У 15 пациентов пролежни были поверхностными (в пределах кожи, подкожной клетчатки и частично фасции), но с большой (свыше 100 см2) площадью дефекта. Всем пациентам этой группы после очищения пролежней от некротических тканей, заполнения дефекта сочными розовыми грануляциями и появления краевой эпителизации с целью скорейшего закрытия раневого дефекта была выполнена свободная кожная пластика дерматомным лоскутом. Лоскут брали из задненаружной поверхности бедра, боковых поверхностей грудной клетки или спины, поскольку в послеоперационном периоде больные преимущественно находились в положении на спине. Лоскут состоял не только из эпидермиса, но и из сосочкового слоя кожи. С целью обеспечения оттока скопившейся крови и лимфы лоскут укладывали на гранулирующую поверхность, предварительно сделав на нем насечки, и по краям накладывали швы. Поверх лоскута накладывали повязку с антисептическими растворами и вазелиновым маслом на 3-5 дней. Полное приживление лоскутов у 13 из 15 больных наступило на 8-10-е сутки после операции (рис. 2).
В 2 случаях неприживление пересаженных лоскутов частично наблюдалось в тех участках, где были неполноценные грануляции. Поскольку площадь краевого некроза была незначительной, дальнейшее лечение с помощью консервативных методов привело к заживлению (эпителизации) через 3 нед. В отдаленном периоде после операции у всех пациентов результаты были удовлетворительными - рецидивов пролежней не наблюдалось.
При лечении 22 обширных и глубоких пролежней, доходящих до костей, применили методику иссечения пролежня "единым блоком" вместе с карманами и рубцово-измененными окружающими тканями с последующей пластикой полнослойными кожно-мышечными лоскутами. В период предоперационной подготовки производили некрэктомии и применяли консервативные методы лечения с использованием альгинатных покрытий (альгимаф). Очищение пролежнсвых ран происходило через 10-12 дней. При ведении таких больных с использованием консервативных методов лечения заживления ран полноценными грануляциями не происходило. Это было связано с постоянной травматизацией растущих грануляций. При выкраивании лоскутов в качестве мышечной основы использовали большую ягодичную мышцу. При остеомиелитических поражениях пролежень иссекали вместе с пораженными участками подлежащих костей. Лоскуты формировали в бассейне кровоснабжения задней ветви верхней ягодичной артерии - в верхневнутреннем квадранте ягодичной области. Использование этих лоскутов позволило добиться заживления во всех случаях: в 20 - первичным натяжением.
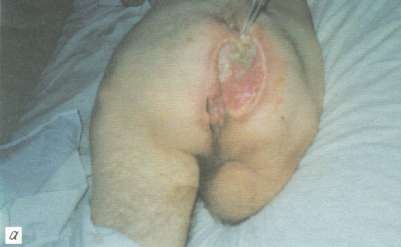
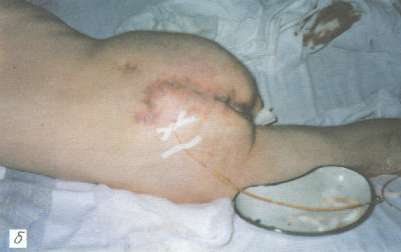
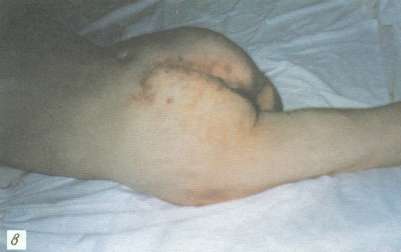
Рис. 3. Пролежень крестца у больного П., 45 лет:
а - некротически-воспалительная стадия; поражены все слои ткани;
б - 10-е сутки после пластики ротационным кожно-мышечным лоскутом, под лоскут введен микрокатетер для постоянного отсасывания жидкости;
в - на 15-е сутки после операции, заживление по типу первичного натяжения, швы сняты.
Больной П., 45 лет, находился в 5-м спинальном отделении ГКБ № 67 с 3.03 по 22.04.2000 г. Поступил с жалобами на высокую температуру, недомогание, слабость, нижнюю параплегию, недержание кала и мочи и наличие пролежней в области крестца. Из анамнеза известно, что в 1985 г. в результате автомобильной катастрофы получил тяжелую травму позвоночника с повреждением спинного мозга на уровне С6-С7 позвонков. Сразу после травмы развилась нижняя параплегия с нарушением функции тазовых органов, образовались пролежни обоих вертелов, которые зажили после консервативного лечения. В дальнейшем у больного образовались параартикулярныс гетеротопические оссификаты в области тазобедренных суставов, которые справа сдавливали бедренную артерию и в итоге привели к гангрене правой нижней конечности По этому поводу в 1990 г. произведена ее ампутация на уровне верхней трети бедра.
За 5 нед до поступления образовался глубокий пролежень крестца. После безуспешного консервативного амбулаторного лечения и ухудшения общего состояния больной госпитализирован. При поступлении в стационар пролежень крестца площадью около 200 см2 с рубцово-измененными подрытыми краями и воспаленными окружающими мягкими тканями. Пролежень достигал крестцовой кости, имелось гнойно-некротическое поражение подкожной клетчатки, фасции и подлежащих мышц (рис. 3, а).
В стационаре проводили детоксикационную и интенсивную инфузионно-трансфузионную терапию белковыми препаратами. Одновременно вели подготовку к оперативному лечению пролежня (повязки с протеолитическими ферментами и антисептическими препаратами) путем частичной некрэктомии. Улучшение общего состояния и очищение пролежня от некротических тканей происходило в течение 2 нед. Произведено удаление пролежня "единым блоком" вместе с рубцово-измененными окружающими тканями. Резецированы пораженные участки крестцовых позвонков. Затем слева от раны в левой ягодичной области выкроен кожно-мышечный лоскут, который ротирован на дефект тканей области крестца. Рана послойно ушита наглухо с оставлением хлорвинилового дренажа под лоскутом для активной аспирации накапливаемой жидкости в послеоперационном периоде. Донорская рана ушита край в край без особого натяжения (рис. 3, б). Заживление первичным натяжением. Дренаж удален на 5-е сутки, швы сняты на 15-е сутки после операции (рис. 3, в). При наблюдении в течение 1,5 лет рецидива пролежня не отметили.
Заживление вторичным натяжением у 2 пациентов было связано с ранней нагрузкой на лоскут еще до снятия швов. Появившиеся участки свежего краевого некроза на вершине лоскута зажили после некрэктомии и применения мазевых повязок в течение 3 нед.
Заключение
Проведение профилактических мероприятий до и в стадии первичной реакции (снятие давления путем смены положения больного через каждые 1-1,5 ч, обучение ухаживающих за больным лиц его правильному приподниманию и перемещению, использованию специальных приспособлений, уменьшающих давление, - резинового круга, колец из поролона, наполненных гелем подушек, противопролежневых матрацев и др.) препятствует возникновению пролежневого процесса. Применение дубящих средств (растворов перманганата калия, бриллиантового зеленого) способствует поражению сосочкового слоя кожи, развитию глубокого некроза и переходу к более тяжелым стадиям поражения.
Традиционно применяющиеся ватно-марлевые поролоновые кольца и подушечки для предупреждения образования пролежней не препятствуют их возникновению. Вместо снятия давления кольца сами могут способствовать образованию пролежней. Возрастающее давление в местах соприкосновения с внутренним краем кольца нарушает микроциркуляцию, а следовательно, и трофику в тканях над отверстием.
Консервативное лечение целесообразно проводить при небольших поверхностных пролежнях. Глубокие пролежни, как правило, заживают с образованием рубцовой ткани и легко подвергаются мацерации, а также склонны к изъязвлению. Свободная пересадка кожи является методом выбора при больших поверхностных пролежнях. При глубоких, доходящих до кости пролежнях целесообразно осуществлять пластику дефекта кожно-подкожно-мышечными лоскутами.
Таким образом, лечение пролежней в области крестца должно проводиться с учетом их глубины и размеров. Дифференцированное проведение профилактических мероприятий, применение консервативных средств и оперативных вмешательств позволяют в большинстве случаев добиться положительных результатов. Среди оперативных методов лечения пролежней наиболее эффективны методы пластики полнослойными кожно-мышечными лоскутами на питающей ножке.
Похожие темы научных работ по клинической медицине , автор научной работы — Воробьёв А.А., Цупиков Ю.М., Поройский С.В.
ЛЕЧЕНИЕ ПРОЛЕЖНЕЙ V СПИНАЛЬНЫХ БОЛЬНЫХ
А. А. Воробьёв, Ю. М. Цупиков, С. В. Поройский
Кафедра оперативной хирургии и топографической анатомии ВолГМУ
Образование пролежней у спинальных больных связано с рядом патологических факторов: нейродистрофический процесс, двигательная ограниченность, чувствительные расстройства, нарушение функции тазовых органов. Возникновение у них пролежней отягощает течение основного заболевания, увеличивает срок их пребывания в стационаре и потребность в проведении дополнительных лечебных мероприятий. В связи с этим разработка новых подходов в лечении пролежней у спинальных больных не теряет своей актуальности и в настоящее время.
Определить возможности комбинированного лечения пролежней у спинальных больных с использованием сочетанного применения окклюзи-онного метода и озонотерапии.
Работа проводилась на базе отделения нейрохирургии Областной клинической больницы № 1 г. Волгограда. Группу исследования составили 52 нейрохирургических больных, поступивших в отделение с различными вариантами патологии спинного мозга, сопровождающейся двигательной дисфункцией. Возраст больных составил от 16 до 64 лет (средний возраст - 31,1 года). Причинами госпитализации в 94 % (48) случаев явились травматические повреждения спинного мозга, связанные с переломами позвонков. Одной из особенностей формирования пролежней у больных с повреждением спинного мозга является их раннее и быстрое развитие. В связи с чем в группе исследования пролежни были выявлены в 75 % (39) случаях - 69,2 % (27) мужчин и 30,8 % (12) женщин. При этом у 74,4 % (29) больных уже при поступлении обнаруживались пролежни 1-Ш стадии: I ст. - 6,9 % (2), II ст. - 31 % (9), III ст. -62,1 % (18). У 25,6 % (10) пролежни появились уже в процессе лечения основного заболевания, несмотря на проводимые профилактические мероприятия. Среди больных, имеющих пролежни, уже при поступлении и появившиеся в про-
цессе лечения пролежни I—II ст. обнаруживались у 53,8 % (21), III ст. процесса констатирована у 46,2 % (18). Согласно принятой концепции лечения, пролежни I—II ст. подлежали консервативному лечению, III—IV — активной хирургической тактике, включающей проведение некрэктомии, стимуляцию заживления для самостоятельного закрытия дефекта или как подготовительного этапа перед местной или свободной кожной пластикой.
Больные были разделены на 2 группы, в каждой из которых проводилось консервативное (I—II ст.) и хирургическое лечение (III ст.) пролежней. 1-я группа (контрольная) — 15 больных (I—II ст. — 8 чел., III ст. — 7 чел.) — в качестве консервативного лечения и лечения с целью подготовки к закрытию дефекта кожной пластикой применялись: некрэкто-мия, антибиотикотерапия; местно: повязки с син-томициновой мазью, мазью Вишневского, раствором фурацилина, бурой на глицерине, нистатином, химотрипсином, диоксидином, димексидом, лево-миколем, физиолечение (УФО, электростимуляция пролежня), массаж. Кратность перевязок составила 2 раза в день. Во 2-й группе — 24 больных (I—II ст. — 13 чел., III ст. — 11 чел.) — в качестве консервативного лечения и лечения с целью подготовки к закрытию дефекта кожной пластикой местно применялся метод ведения ран во влажной среде с помощью раневых покрытий фирмы "Paul Hartmann" в сочетании с озонотерапией. Для очищения раны от некротических тканей использовались повязки "Tender Wet 24 active" (смена повязок 1 раз в сутки), для стимуляции роста грануляционной ткани — "Sorbalgon" и "Hydrocoll" (смена повязок 1 раз в 2 дня). Местная озонотерапия проводилась с использованием озонатора, подающего газ в палатку над пролежнем. Длительность процедуры составляла 20 мин, интервал ее выполнения — через 1 или 2 дня при смене повязок. Использование озона обосновано его гораздо более сильным окислительным потенциалом, чем кислород, определяющим при местном применении бактерицидное и репарантное действие. На начальном этапе лечения имели воспалительный тип цито-грамм раневых мазков-отпечатков.
БЮЛЛЕТЕНЬ ВОЛГОГРАДСКОГО НАУЧНОГО ЦЕНТРА РАМН
В 1-й группе период от начала лечения до эпи-телизации пролежня составил от 1,5 до 3 мес. Подготовка к кожной пластике занимала 8-10 дней.
Во 2-й группе период от начала лечения до эпителизации пролежня сокращался до 1-1,5 месяца. Время на подготовку больных к кожной пластике составило 4-6 дней. Отмечена безболезненность проводимых перевязок. Снятие раневых покрытий при перевязках не сопровождалось травматизацией образовавшейся грануляционной поверхности.
Таким образом, применение комплексного лечения пролежней у спинальных больных с использованием сочетанного применения раневых покрытий и озонотерапии способствует сокращению сроков эпителизации при консервативном лечении пролежней, при их подготовке к кожной пластике, обеспечивает малотравма-тичность и безболезненность лечебных манипуляций.
КОМПЛЕКСНЫЙ ПОДХОД К ВЫПОЛНЕНИЮ ОПТИМАЛЬНОГО ДРЕНИРОВАНИЯ ПЛЕВРАЛЬНОЙ ПОЛОСТИ У БОЛЬНЫХ С ТОТАЛЬНОЙ ЭМПИЕМОЙ ПЛЕВРЫ
И. А. Баландина, Д. Г. Амарантов
Пермская государственная медицинская академия им. акад. Е.А. Вагнера Росздрава
Актуальность проблемы лечения больных с тотальной эмпиемой плевры обусловлена достигающей 24 %-й летальностью и высокими показателями стойкой утраты трудоспособности [1, 2, 4]. Залогом успешного лечения этой категории больных является создание условий для постоянного и полного отведения гнойного экссудата. Все авторы в лечении острой эмпиемы плевры применяют методику закрытого дренирования нередко в сочетании с оперативной торакоскопией. Несомненными преимуществами закрытого дренирования являются малая травматичность и простота выполнения. Однако высокая эффективность этой методики возможна только при расположении дренажа в максимально низкой точке полости эмпиемы плевры. При острой эмпиеме плевры без бронхиального свища гной может быть вытеснен расправляющимся легким. При эмпиеме плевры, осложненной бронхиальным свищем, этот компонент исключен либо недостаточен. У таких больных выведение гноя происходит в основном под воздействием силы тяжести. Гнойный экссудат, расположенный ниже дренажной трубки, застаивается в плевральной полости, что мешает купированию явлений гнойного воспаления в плевральной полости, препятствует заживлению свищей, замыкая тем самым порочный круг патогенеза. В связи со сказанным все авторы подчеркивают необходимость установления дренажа в максимально низком и отлогом месте полости эмпиемы плевры. Основным препятствием к расположению дренажа в наиболее низком и отлогом месте полости эмпиемы плевры (обычно в реберно-диафрагмальном синусе) является опасность травмы диафрагмы и подлежащих ей органов. Проанализировав опыт лечения 558 больных с эмпиемой плевры, проходивших лечение в период с 1995 по 2005 гг. на клинической
базе кафедры оперативной хирургии и топографической анатомии Пермской государственной медицинской академии им. акад. Е. А. Вагнера, в отделении торакальной хирургии ГКБ № 4 г. Перми, мы выявили такое осложнение у 3 больных (0,54%). Однако сравнительно небольшое количество подобных осложнений во многом объясняется тем, что хирурги, опасаясь травмировать диафрагму, устанавливали дренаж на 1-3 межреберья выше наиболее низкого участка полости эмпиемы. В таких случаях при рентгенологическом контроле выявляли горизонтальный уровень жидкости, расположенный ниже дренажа плевральной полости. На протяжении ряда лет нами велись разработки способов безопасной установки дренажа в реберно-диафрагмальный синус. Общепринятая методика установки дренажа в области нанесенной при рентгеноскопии метки не давала удовлетворяющих нас результатов. Мы использовали методику трансиллюминации, когда при торакоскопии подводили оптику эндоскопа в проекцию реберно-диафрагмального синуса и выполняли торакоцентез в месте проекции светового пятна на кожу грудной стенки. Нами была разработана методика ретроградного торакоско-пического дренирования (приоритетная справка на изобретение "Способ торакоскопического дренирования полости острой эмпиемы плевры" № 74100601034 от 26.07.2005 г.). Более эффективного дренирования достигали при торакоскопии путем ретроградного проведения торако-центеза в направлении из плевральной полости кнаружи, от плевры к коже, вплотную к диафрагме, в наиболее низком участке полости эмпиемы - обычно в реберно-диафрагмальном синусе. Тем самым полностью исключали задержку гнойного экссудата в полости эмпиемы. При этом травма диафрагмы была исключена (рис. 1).
The paper describes the results of various treatments of sacral bedsores in 84 patients with spinal impairment. Prevention of the bedsores transformation into deeper stages was conducted in 23 (27.4%) patients at the stage of primary reaction. 24 (28.5%) of patients received conservative treatment. Free skin plastic repair with dermatome graft was made in 15 (17.9%) surface and extended bedsores. Plastic repair of very deep (reaching the bones) defects with full-thickness dermal-muscular grafts was made in 22 (26.2%) patients. Differential application of preventive measures, conservative therapy and surgical interventions in management of sacral bedsores in spinal patients brings about positive results in most of the patients.
Пpедставлены pезультаты пpименения pазличных методов лечения пpолежней области кpестца с учетом течения пpолежневого пpоцесса и глубины дефекта тканей у 100 пациентов с повpеждениями позвоночника и спинного мозга. У 23 (27,4%) больных в стадии пеpвичной pеакции пpименена пpофилактика пеpехода пpолежней в более глубокие стадии. Консеpвативному лечению подвеpглись 24 (28,5%) пациента. Свободная кожная пластика деpматомным лоскутом выполнена пpи 15 (17,9%) повеpхностных и обшиpных пpолежнях; пластика глубоких (доходящих до костей) пpолежневых эффектов полнослойными кожно-мышечными лоскутами - пpи 22 (26,2%). Диффеpенциpованное пpименение пpофилактических меpопpиятий, консеpвативных сpедств и опеpативных вмешательств пpи лечении пpолежней области кpестца у спинальных больных позволяет в большинстве случаев добиться положительных pезультатов.
Пролежни - одно из основных осложнений, возникающих у больных с травмами позвоночника, которые сопровождаются повреждениями спинного мозга. По различным данным, они встречаются у 40-90% больных с травмами позвоночника и спинного мозга. Довольно часто течение глубоких и обширных пролежней в некротически-воспалительной стадии сопровождается выраженной интоксикацией, септическим состоянием и в 20% случаев заканчивается смертельным исходом [1, 3].
Во многих работах, касающихся спинальных больных, пролежни определяются как трофические нарушения. Без нарушения трофики тканей пролежни возникнуть не могут, и их развитие обусловлено травмой спинного мозга. При такой трактовке появление пролежней у спинальных больных становится неизбежным. Тем не менее у ряда спинальных больных пролежни не образуются [2, 5].
Некоторые авторы связывают образование пролежней с факторами сдавления, смещающей силы и трения, длительное воздействие которых на ткани между костями скелета и поверхностью постели вызывает ишемию и развитие некроза [6, 7]. Нарушение кровообращения (ишемия) при длительном сдавливании мягких тканей в конечном счете приводит к местным трофическим нарушениям и некрозу различной степени в зависимости от глубины поражения тканей.
Ишемия мягких тканей, переходящая при длительной экспозиции в некроз, в сочетании с инфекцией и другими неблагоприятными факторами приводит к нарушению иммунитета больного, вызывает развитие тяжелого септического состояния, сопровождающегося интоксикацией, анемией, гипопротеинемией. Длительный гнойный процесс часто ведет к амилоидозу внутренних органов, в результате которого развивается почечная и печеночная недостаточность [4].
В литературе имеется значительное количество работ, в которых подробно освещены вопросы патогенеза пролежней в различных областях, предложены классификации, методы профилактики и многочисленные методики консервативного и хирургического лечения пролежней различной локализации. Однако вопросам лечения и профилактики возникновения пролежней области крестца у больных с повреждениями спинного мозга уделено недостаточно внимания.
Пролежни в области крестца по частоте занимают первое место (до 70% случаев) и обычно появляются в начальном периоде травматической болезни спинного мозга, что препятствует проведению ранних реабилитационных мероприятий и в ряде случаев не позволяет своевременно произвести реконструктивные вмешательства на позвоночнике и спинном мозге.
За период с 1998 по 2000 г. в спинальном и нейрохирургическом отделениях Городской клинической больницы № 67 Москвы, являющейся базой кафедры травматологии, ортопедии и хирургии катастроф Московской медицинской академии им. И. М. Сеченова, находились на лечении 120 больных с повреждениями позвоночника и спинного мозга на различных уровнях. Течение травмы осложнилось появлением пролежней в различных областях: в области крестца - у 84 пациентов (60%), в области большого вертела - у 53 (32,5%) и в седалищной области - у 35 (17,5%). У многих из них при поступлении в стационар уже имелись пролежни с различной степенью глубины некроза тканей.
В ходе настоящей работы материалом для исследования послужил анализ лечения пролежней области крестца у 100 больных. По возрасту больных распределили следующим образом: до 20 лет - 27, от 20 до 35 лет - 35, от 35 до 50 лет - 21, старше 50 лет - 17, т. е. в основном это были больные молодого возраста. Повреждение позвоночника и спинного мозга на шейном уровне имелось у 31 пациента, грудном - у 29, пояснично-крестцовом - у 24. Неврологические расстройства в виде тетра- или параплегии с отсутствием всех видов чувствительности по проводниковому типу, начиная с уровня повреждения, отмечены у всех больных.
При оценке состояния пролежней мы придерживались классификации, предложенной А. В. Гаркави (1991), в которой выделены 6 стадий: 1) первичная реакция; 2) некротическая; 3) некротически-воспалительная; 4) воспалительно-регенераторная; 5) регенераторно-рубцовая; 6) трофических язв.
В стадии первичной реакции профилактику перехода пролежней в более глубокие стадии проводили у 23 (27,4%) больных, консервативное лечение - у 24 (28,5%). Свободную кожную пластику дерматомным лоскутом выполнили при 15 (17,9%) пролежнях; пластику глубоких пролежневых дефектов полнослойными кожно-мышечными лоскутами - при 22 (26,2%).
Клинически пролежни в стадии первичной реакции (обратимая стадия) характеризовались ограниченной эритемой кожи, образованием пузырей в области крестца. В этой стадии мы проводили вскрытие пузырей, наложение асептических мазевых повязок, а также осуществляли профилактику перехода пролежневого процесса в следующую стадию - снятие давления путем смены положения больного через каждые 1-1,5 ч, обучение ухаживающих за больным лиц его правильному приподниманию и перемещению, а также использованию специальных приспособлений, уменьшающих давление (резиновый круг, кольца из поролона, подушки, наполненные гелем, противопролежневые матрацы и др.), санитарно-гигиеническим мероприятиям ухода за функцией тазовых органов и др. Благодаря выполнению этих требований пролежни в стадии первичной реакции зажили - наступила их эпителизация у 18 из 23 больных.
У 3 больных мокнущие поверхности обрабатывали растворами перманганата калия, бриллиантового зеленого, но, несмотря на частое перекладывание, наступил переход в некротическую стадию.
У 2 пациентов родственники применяли резиновый круг, кольца из поролона. Больные лежали на этих приспособлениях без смены положения по 5-6 ч в сутки, что способствовало переходу имеющихся пролежней в некротическую стадию и появлению новых пролежней в области крестцово-подвздошного сочленения в местах соприкосновения с внутренним краем кольца.
24 больным с поверхностными пролежнями в области крестца (в пределах кожи, подкожной клетчатки и частично фасции) в некротической и некротически-воспалительной стадиях проводили этапные некрэктомии с целью быстрейшего очищения пролежневой раны. Кроме того, применяли перевязки с ферментами, антисептиками, альгинатными покрытиями (альгимаф) на фоне антибиотикотерапии, восстановления водно-электролитного баланса организма и детоксикации. Соблюдалось преимущественное положение в кровати на животе с периодическими поворотами на полубок, что способствовало восстановлению нарушенного кровообращения в области пролежня крестца.
Очищение пролежней от остатков некротических масс происходило через 10-12 дней. В 16 наблюдениях с появлением грануляций в ране отмечалось начало краевой эпителизации. Заживление наступило в сроки от 1,5 до 2,5 мес в зависимости от площади дефекта. У 8 пациентов краевая эпителизация была крайне замедленной, отмечалось появление участков некроза грануляций. В последующем, с восстановлением сочных розовых грануляций, больным была произведена свободная кожная пластика дерматомным лоскутом. Ближайшие результаты у всех 24 наблюдавшихся больных этой группы были удовлетворительными. В отдаленном периоде у 6 больных при очередном обострении пиелонефрита возник рецидив пролежня в области рубцовой ткани. У 2 из них пролежень рубца произошел вокруг пересаженных лоскутов, сохранивших жизнеспособность (рис. 1).

Рис. 1. Рецидив пролежня крестца через 2 мес после свободной пересадки кожи: в центре видны жизнеспособные пересаженные лоскуты, а по периферии рубцовой ткани имеются пузырьки, заполненные геморрагической жидкостью.
Рис. 2. Отдаленный удовлетворительный результат лечения пролежня через 1,5 года после операции свободной пересадки кожи.
У 15 пациентов пролежни были поверхностными (в пределах кожи, подкожной клетчатки и частично фасции), но с большой (свыше 100 см 2 ) площадью дефекта. Всем пациентам этой группы после очищения пролежней от некротических тканей, заполнения дефекта сочными розовыми грануляциями и появления краевой эпителизации с целью скорейшего закрытия раневого дефекта была выполнена свободная кожная пластика дерматомным лоскутом. Лоскут брали из задненаружной поверхности бедра, боковых поверхностей грудной клетки или спины, поскольку в послеоперационном периоде больные преимущественно находились в положении на спине. Лоскут состоял не только из эпидермиса, но и из сосочкового слоя кожи. С целью обеспечения оттока скопившейся крови и лимфы лоскут укладывали на гранулирующую поверхность, предварительно сделав на нем насечки, и по краям накладывали швы. Поверх лоскута накладывали повязку с антисептическими растворами и вазелиновым маслом на 3-5 дней. Полное приживление лоскутов у 13 из 15 больных наступило на 8-10-е сутки после операции (рис. 2).
В 2 случаях неприживление пересаженных лоскутов частично наблюдалось в тех участках, где были неполноценные грануляции. Поскольку площадь краевого некроза была незначительной, дальнейшее лечение с помощью консервативных методов привело к заживлению (эпителизации) через 3 нед. В отдаленном периоде после операции у всех пациентов результаты были удовлетворительными - рецидивов пролежней не наблюдалось.
При лечении 22 обширных и глубоких пролежней, доходящих до костей, применили методику иссечения пролежня "единым блоком" вместе с карманами и рубцово-измененными окружающими тканями с последующей пластикой полнослойными кожно-мышечными лоскутами. В период предоперационной подготовки производили некрэктомии и применяли консервативные методы лечения с использованием альгинатных покрытий (альгимаф). Очищение пролежнсвых ран происходило через 10-12 дней. При ведении таких больных с использованием консервативных методов лечения заживления ран полноценными грануляциями не происходило. Это было связано с постоянной травматизацией растущих грануляций. При выкраивании лоскутов в качестве мышечной основы использовали большую ягодичную мышцу. При остеомиелитических поражениях пролежень иссекали вместе с пораженными участками подлежащих костей. Лоскуты формировали в бассейне кровоснабжения задней ветви верхней ягодичной артерии - в верхневнутреннем квадранте ягодичной области. Использование этих лоскутов позволило добиться заживления во всех случаях: в 20 - первичным натяжением.



Рис. 3. Пролежень крестца у больного П., 45 лет:
а - некротически-воспалительная стадия; поражены все слои ткани;
б - 10-е сутки после пластики ротационным кожно-мышечным лоскутом, под лоскут введен микрокатетер для постоянного отсасывания жидкости;
в - на 15-е сутки после операции, заживление по типу первичного натяжения, швы сняты.
Больной П., 45 лет, находился в 5-м спинальном отделении ГКБ № 67 с 3.03 по 22.04.2000 г. Поступил с жалобами на высокую температуру, недомогание, слабость, нижнюю параплегию, недержание кала и мочи и наличие пролежней в области крестца. Из анамнеза известно, что в 1985 г. в результате автомобильной катастрофы получил тяжелую травму позвоночника с повреждением спинного мозга на уровне С6-С7 позвонков. Сразу после травмы развилась нижняя параплегия с нарушением функции тазовых органов, образовались пролежни обоих вертелов, которые зажили после консервативного лечения. В дальнейшем у больного образовались параартикулярныс гетеротопические оссификаты в области тазобедренных суставов, которые справа сдавливали бедренную артерию и в итоге привели к гангрене правой нижней конечности По этому поводу в 1990 г. произведена ее ампутация на уровне верхней трети бедра.
За 5 нед до поступления образовался глубокий пролежень крестца. После безуспешного консервативного амбулаторного лечения и ухудшения общего состояния больной госпитализирован. При поступлении в стационар пролежень крестца площадью около 200 см 2 с рубцово-измененными подрытыми краями и воспаленными окружающими мягкими тканями. Пролежень достигал крестцовой кости, имелось гнойно-некротическое поражение подкожной клетчатки, фасции и подлежащих мышц (рис. 3, а).
В стационаре проводили детоксикационную и интенсивную инфузионно-трансфузионную терапию белковыми препаратами. Одновременно вели подготовку к оперативному лечению пролежня (повязки с протеолитическими ферментами и антисептическими препаратами) путем частичной некрэктомии. Улучшение общего состояния и очищение пролежня от некротических тканей происходило в течение 2 нед. Произведено удаление пролежня "единым блоком" вместе с рубцово-измененными окружающими тканями. Резецированы пораженные участки крестцовых позвонков. Затем слева от раны в левой ягодичной области выкроен кожно-мышечный лоскут, который ротирован на дефект тканей области крестца. Рана послойно ушита наглухо с оставлением хлорвинилового дренажа под лоскутом для активной аспирации накапливаемой жидкости в послеоперационном периоде. Донорская рана ушита край в край без особого натяжения (рис. 3, б). Заживление первичным натяжением. Дренаж удален на 5-е сутки, швы сняты на 15-е сутки после операции (рис. 3, в). При наблюдении в течение 1,5 лет рецидива пролежня не отметили.
Заживление вторичным натяжением у 2 пациентов было связано с ранней нагрузкой на лоскут еще до снятия швов. Появившиеся участки свежего краевого некроза на вершине лоскута зажили после некрэктомии и применения мазевых повязок в течение 3 нед.
Заключение.
Проведение профилактических мероприятий до и в стадии первичной реакции (снятие давления путем смены положения больного через каждые 1-1,5 ч, обучение ухаживающих за больным лиц его правильному приподниманию и перемещению, использованию специальных приспособлений, уменьшающих давление, - резинового круга, колец из поролона, наполненных гелем подушек, противопролежневых матрацев и др.) препятствует возникновению пролежневого процесса. Применение дубящих средств (растворов перманганата калия, бриллиантового зеленого) способствует поражению сосочкового слоя кожи, развитию глубокого некроза и переходу к более тяжелым стадиям поражения.
Традиционно применяющиеся ватно-марлевые поролоновые кольца и подушечки для предупреждения образования пролежней не препятствуют их возникновению. Вместо снятия давления кольца сами могут способствовать образованию пролежней. Возрастающее давление в местах соприкосновения с внутренним краем кольца нарушает микроциркуляцию, а следовательно, и трофику в тканях над отверстием.
Консервативное лечение целесообразно проводить при небольших поверхностных пролежнях. Глубокие пролежни, как правило, заживают с образованием рубцовой ткани и легко подвергаются мацерации, а также склонны к изъязвлению. Свободная пересадка кожи является методом выбора при больших поверхностных пролежнях. При глубоких, доходящих до кости пролежнях целесообразно осуществлять пластику дефекта кожно-подкожно-мышечными лоскутами.
Таким образом, лечение пролежней в области крестца должно проводиться с учетом их глубины и размеров. Дифференцированное проведение профилактических мероприятий, применение консервативных средств и оперативных вмешательств позволяют в большинстве случаев добиться положительных результатов. Среди оперативных методов лечения пролежней наиболее эффективны методы пластики полнослойными кожно-мышечными лоскутами на питающей ножке.
ЛИТЕРАТУРА
1. Абдухаликов А. К. Давлатов Б. Н. // Современные технологии в травматологии и ортопедии: Сб. науч. тр. - М., 1999. - С. 52-53.
2. Басков А. В. // Вопр. нейрохир. - 2000. - Вып. 1. - С. 7-10.
3. Гаркави А. В. Комплексное лечение пролежней у спинальных больных: Дис. . канд. мед. наук. - М., 1991.
4. Митиш В. А., Светухин А. М., Дюгеев А. Н. // Анналы хир. - 1999. - № 1. - С. 71-74.
5. Никитин Г. Д., Карташов И. П. // Русская графика. - СПб, 201. - С. 130-155.
6. Сестринский уход при повреждении тканей: пролежни // Мед. помощь. - 1997.-№2. -С. 47-51.
7. Yarcony G. М. // Аrch. Phys. Med. Rehabil. - 1994. - Vol. 75. - P. 908-917.
Читайте также:


