Постинтубационный стеноз шейного отдела трахеи
Трахея представляет собой трубку, которая связывает гортань с бронхами. Основной ее функцией является проведение воздуха в легкие и из легких. У взрослых трахея начинается на уровне 6-7 шейных позвонков и оканчивается на уровне тел 4-5 грудных позвонков делением на два главных бронха. Длина трахеи 10-13 см, ширина – 1,5 – 2,5 см.
Поперечный размер трахеи больше чем переднезадний. У взрослого мужчины поперечный размер составляет примерно 2,3 см, переднезадний – 1,8 см. Соответствующие размеры у женщины: 2,0 и 1,4 см. Толщина стенки 3 мм. Трахея состоит из 18-22 хрящевых колец, благодаря которым сохраняется ее просвет. Задняя часть хряща замещена соединительной тканью с эластическими и гладкими мышечными волокнами. Внутренняя слизистая оболочка трахеи состоит из многослойного реснитчатого эпителия. Наличие реснитчатого эпителия и слизистых желез способствует удалению различных примесей, попадающих с воздухом.
Различают шейную и грудную части трахеи, граница между которыми соответствует яремной вырезке грудины спереди и второму грудному позвонку сзади. В грудном отделе трахеи выделяют три части: верхнегрудную, среднегрудную и надбифуркационную. Длина шейной части трахеи примерно 5 см, что соответствует 6-8 хрящевым кольцам. При разгибании шеи длина шейной части трахеи, как и число хрящей, существенно увеличивается. Начальные кольца трахеи располагаются на глубине 1,5-2см, на уровне яремной вырезкой - на глубине 4-6 см.
Спереди и с боков начальный отдел трахеи прикрыт щитовидной железой. Ниже железы спереди трахеи располагается претрахеальное клетчаточное пространство, в котором в грудной полости находится вилочковая железа. Кзади и несколько слева от трахеи лежит пищевод. В трахеопищеводной борозде слева на передней стенке пищевода проходит левый возвратный нерв. Правый возвратный нерв проходит позади трахеи на правой боковой стенке пищевода. В средостении спереди трахеи на уровне 1 ребра проходит левая плечеголовная вена. Позади нее трахею примерно посередине пересекает плечеголовной ствол, который проходит косо слева направо, непосредственно примыкая к ее передней стенке. Справа от грудной части трахеи располагаются верхняя полая вена, непарная вена и правая плечеголовная вена. К бифуркации трахеи прилежит дуга аорты и левая общая сонная артерия. Кровоснабжение шейного отдела трахеи осуществляется преимущественно ветвями нижних щитовидных артерий, надбифуркационный отдел трахеи и главные бронхи кровоснабжаются бронхиальными артериями. Кроме того, источниками кровоснабжения трахеи являются также ветви подключичной, внутренней грудной и плечеголовной артерий. Сосуды входят в трахею по боковым стенкам несколько кпереди от трахеопищеводной борозды. Венозный отток осуществляется преимущественно через вены щитовидной железы.
История хирургии трахеи
Вмешательства на трахее известны давно. Их выполняли еще за 3500 лет до нашей эры в Древнем Египте и за 2000 лет в Индии. Старейшей и наиболее распространенной в настоящее время операцией на трахее является трахеостомия. О разрезах дыхательного горла при травме, сопровождающейся обструкцией дыхательных путей сообщалось еще за 1500 лет до нашей эры. Beatrous описал, как Александр Македонский кончиком своего меча выполнил трахеостомию солдату. Galen и Aretaeus во втором-третьем веках нашей эры также описывали эту операцию. В это время трахею именовали бурной артерией или трахеальной артерией, считая, что по ней проходит не только воздух, но и кровь. Имена хирургов, возможно выполнявших трахеостомию, не известны. До 19 века многие считали это вмешательство бесперспективным и вредным. Goodall в 1934 году провел исследование, при котором установил, что до 19 века было выполнено только 28 успешных трахеотомий. Сдерживало применение метода плохое знание анатомии и неудовлетворительные результаты. В связи с высокой смертностью до 18 века при удушье, вызванном обструкцией верхних дыхательных путей, чаще применяли кровопускание.
 |
| Рис.5. Картина Piero di Cosima в Национальной Галерее в Лондоне. |
Популяризации трахеостомии в 19 веке способствовало сообщение Trousseau о выполненной им трахеостомии при тяжелой дифтерии, позволившей спасти одного из четырех больных.
Первые резекции шейного отдела трахеи с анастомозом конец в конец выполнили на собаках Gluck и Zeller в 1881 году. Первую резекцию трахеи по поводу посттравматического стеноза шейного отдела трахеи успешно осуществил в 1886 году Kuster. В начале двадцатого века Nowakowski и Levit применяли для закрытия дефектов трахеи кожу, широкую фасцию бедра.
Циркулярная резекция трахеи наиболее долго из других вмешательств в торакальной хирургии внедрялась в практику, что было связано как с ее сложностью, так и с редкой необходимостью ее выполнения. Интерес к реконструктивным операциям на трахее возник в середине двадцатого века. Sanger во время Второй мировой войны и Griffith в 1949 году выполнили реконструктивные операции на бронхах и грудной части трахее. Одной из первых была публикация R.Belsey в 1950 году о резекции внутригрудной части трахеи. Belcher в 1950 году и Mathey в 1951 году осуществили анастомоз главных бронхов после случайного пересечения. J.Mathey в 1951 году впервые выполнил резекцию бифуркации трахеи. Увеличение в последние десятилетия числа больных с рубцовыми стенозами трахеи способствовало широкому внедрению реконструктивных операций на трахее в практику. Большое значение в становлении современной трахеальной хирургии имели работы хирургов, обладающих наибольшим опытом операций на трахее. Это работы J.Mathey, H.Eschapasse, F.G.Pearson, H.C.Grillo и в нашей стране М.И.Перельмана.
Стеноз трахеи
Стеноз трахеи может быть вызван рубцовыми изменениями стенки трахеи, сдавлением ее извне при опухолях средостения, новообразованиях щитовидной железы, аномалийными сосудами средостения и врожденной дезорганизацией тканей стенки трахеи, например при экспираторном стенозе.
Рубцовый стеноз трахеи характеризуется замещением нормальной стенки трахеи рубцовой тканью. Причиной ее появления является повреждение стенки трахеи с последующим развитием гнойно-некротического процесса обычно в месте давления манжеты интубационной трубки на стенку трахеи в процессе длительной искусственной вентиляции легких. Существенное значение в развитии стеноза имеет воспалительный процесс в области трахеостомы, давление конца трахеостомической трубки на стенку трахеи или рубцевание вследствие механического повреждения трахеи. Как правило, стеноз развивается в области трахеостомического отверстия или в области расположения манжеты трахеостомической трубки.
В крайне редких случаях причину стеноза трахеи установить не удается. Подобный стеноз носит название идиопатического. Как правило, им страдают женщины среднего возраста. Плотный келоидный рубец захватывает преимущественно адвентицию верхней трети трахеи, имеет протяженность 1-3 см.
В последние годы отмечается рост числа больных с рубцовыми стенозами трахеи. Благодаря достижением реаниматологии, длительной искусственной вентиляции легких стало возможным спасение больных, которые считались ранее безнадежными. Однако у многих из них через некоторое время развивается картина рубцового стеноза трахеи. По данным Корбера 1999г. стенозирование просвета трахеи после трахеостомии достигает 51%. Law 1993г. сообщил о 67% повреждений трахеи после трахеостомии. Морфологические изменения различны – от повреждения эпителия с образованием эрозий до трансмурального некроза стенки. Симптомы стеноза трахеи могут развиться через неделю или несколько месяцев после экстубации, но у 80% пациентов они появляются в течение первых 3 месяцев.
Профилактика – минимальная травма при трахеостомии, строгое соблюдение принципов асептики при любых манипуляциях на трахее, каждые 2 часа снижение давления в манжетке трахеостомической трубки, перемещение трубки по длине, замена трубки каждые 2 дня, антибиотикопрофилактика с учетом чувствительности микрофлоры.
Наиболее полная классификация рубцовых стенозов трахеи предложена В.Д.Паршиным. Он разделяет стенозы:
- По этиологии: постинтубационный, посттрахеостомический, посттравматический, идиопатический.
- По локализации: гортань (с поражением подскладочного отдела, голосовых складок), шейный отдел трахеи, верхнегрудной, среднегрудной, надбифуркационный отделы трахеи, комбинированные поражения.
- По степени сужения: 1 степень (просвет сужен на 1\3 диаметра дыхательного пути), 2 степень (от 1\3 до 2\3 диаметра), 3 степень (более 2\3 диаметра).
- По распространенности: ограниченный (до 2 см), протяженный (более 2 см).
- По анатомической форме поражения: переднебоковые стенки, циркулярное сужение, атрезия.
- По состоянию стенок трахеи: с трахеомаляцией, без трахеомаляции.
- По наличию трахеостомы: с трахеостомой, без трахеостомы.
Данные анамнеза и появление одышки позволяют заподозрить стеноз трахеи. Одышка носит приступообразный характер, усиливается при небольшой физической нагрузке, уменьшается после откашливания вязкой мокроты. При прогрессирования стеноза отмечается шумное, слышное на расстоянии дыхание. Основными методами подтверждения стеноза и оценки степени сужения являются бронхоскопия и компьютерная томография.
В лечении больных с рубцовыми стенозами трахеи принимают участие не только торакальные хирургии, но и отоларингологи, эндоскописты. Наибольший опыт лечения больных с данной патологией накоплен в РНЦХ им. Б.В.Петровского. Радикальным методом лечения больных с рубцовым стенозом трахеи является циркулярная резекция трахеи, однако она возможна, как правило, при ограниченных стенозах. Консервативное лечение применяют только в начальный период формирования стеноза или как паллиативное лечение при невозможности оперативного вмешательства. Оно заключается в антибиотикотерапии, аэрозольтерапии, применении стероидных и нестероидных противовоспалительных препаратов. Нормальный просвет трахеи восстанавливают с помощью ригидной бронхоскопии, удаляя избыточные грануляции или рассекая суженный участок трахеи с помощью электрокоагуляции, лазерного воздействия. Данное вмешательство можно выполнять не более 3-4 раз. Для сохранения адекватного просвета трахеи осуществляют стентирование ее на срок 4-6 месяцев. После удаления стента добиться сохранения стойкого просвета трахеи удается не более чем у трети больных. Бужирование стеноза трахеи тубусом ригидного бронхоскопа различного диаметра или дилатационным бронхоскопом применяется также при угрозе асфиксии в качестве экстренного паллиативного вмешательства.
При обширных поражениях трахеи выполнить ее резекцию не представляется возможным. В подобных случаях возможна трансплантация трахеи. В 2006 году в РНЦХ была выполнена успешная трансплантация трахеи больному с субтотальным рубцовым стенозом трахеи. Кровоснабжение трахеи осуществляется через сосуды щитовидной железы.
Трахеопищеводные свищи
Наиболее часто трахеопищеводные свищи возникают у больных раком пищевода при распаде опухоли, прорастающей в трахею. Другими причинами являются ранения пищевода и трахеи, перфорация пищевода при его бужировании по поводу рубцовых стриктур, пролежень от трахеостомической и интубационной трубок при длительной искусственной вентиляции легких.
Частота трахеопищеводных свищей не превышает 0,5% среди больных, которым проводилась длительная искусственная вентиляция легких. Как правило, трахеопищеводные свищи у этой группы больных возникают от избыточного давления манжетки интубационной трубки или давления дистального конца трахеостомической трубки на заднюю стенку трахеи при наличии в пищеводе зонда для энтерального питания, что приводит к ее ишемии, некрозу и образованию соустья между пищеводом и трахеей. Часто трахеопищеводные свищи сочетаются со стенозом трахеи, что существенно осложняет лечение таких больных. Заброс пищи в трахею приводит к гнойному трахеобронхиту с последующим развитием абсцедирующей пневмонии, что значительно ухудшает прогноз заболевания. Питание у такого рода больных через рот исключается. Адекватное питание больного обеспечивается через энтеральный зонд или гастростому. Учитывая, что консервативное лечение больных с трахеопищеводными свищами малоэффективно, единственным радикальным способом ликвидации свища неопухолевой природы является оперативное вмешательство.
Клиническая диагностика трахеопищеводных свищей, как правило, не вызывает трудностей. Проявляются они приступообразным кашлем, который возникает во время приема пищи. Однако уточнение их локализации при рентгенологическом исследовании с барием и эзофагоскопии вызывает существенные трудности, особенно при небольших размерах свища. Более информативным оказывается трахеоскопия, при которой удается определить размеры свища, расстояние от голосовых связок и карины. Кроме того, значительную помощь в выявлении трахеопищеводных свищей оказывает также компьютерная томография.
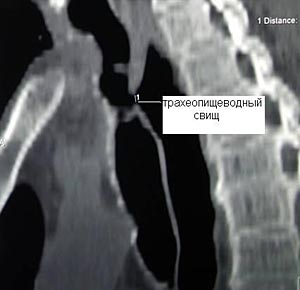 Рис.9. Компьютерная томограмма больного с трахеопищеводным свищом. | 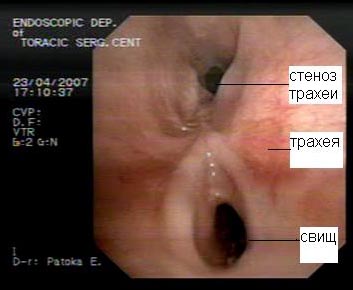 Рис. 10. Трахеоскопия больного с трахеопищеводным свищом, осложненным стенозом трахеи. |
Радикальным методом лечения трахеопищеводных свищей является разъединение пищевода и трахеи с ушиванием дефектов в них и интерпозицией мышц между ними, обычно участка грудиноключичнососцевидной мышцы.
Резекция трахеи
Радикальной операцией, позволяющей удалить стенозированный участок трахеи или опухоль, является циркулярная резекция трахеи. До недавнего времени считалось, что можно безопасно резецировать 2 см трахеи. При необходимости резекции большего участка трахеи для его замещения применяли кожу, перикард, другие ткани, а также различные протезы. Показанием к циркулярной резекции трахеи по поводу стеноза является ограниченный рубцовый стеноз. Важной задачей предоперационной подготовки является адекватное восстановление просвета дыхательного пути с целью устранения гипоксии. Для решения этой задачи выполняют бужирование трахеи жестким бронхоскопом с оставлением больного на сутки на продленной искусственной вентиляции легких через интубационную трубку.
Нецелесообразно выполнять резекцию трахеи при наличии трахеостомы. Ее необходимо предварительно ликвидировать путем эндопротезирования трахеи и ушивания дефекта за 2-3 недели до радикальной операции.
Стентирование трахеи
Различные эндоскопические методы расширения просвета трахеи широко применяются при стенозах доброкачественной и злокачественной природы. Бужирование стенозированного участка трахеи, скусывание опухоли или грануляций, лазерная резекция, фотодинамическая терапия и другие эндоскопические методы позволяют добиться быстрого, однако кратковременного восстановления просвета трахеи. Для предупреждения повторного сужения трахеи применяется ее стентирование. Этот метод является паллиативным методом лечения больных со стенозом трахеи и применяется при невозможности выполнения резекции трахеи или как этап в подготовке больного к радикальной операции. Стентирование возможно также при сужениях анастомозов после трансплантации легкого и циркулярных резекций. Наиболее часто показания для стентирования возникают при нерезектабельных злокачественных опухолях трахеи и крупных бронхов, крупных метастазах в лимфоузлы средостения, вызывающих обструкцию верхних дыхательных путей с выраженной дыхательной недостаточностью.
С ростом дорожно-транспортного травматизма, природных и промышленных катастроф, обострения криминальной обстановки, отмечается увеличение числа больных, нуждающихся в интубации (И). Длительная (И), трахеостомия (Т), выполняемые по витальным показаниям в отделениях интенсивной терапии для адекватной вентиляции легких, у части больных являются причиной стенозирования гортани и трахеи. До настоящего времени нет единой классификации постинтубационных стенозов воздухопроводящих путей. Потому мы решили представить свой многолетний опыт лечения больных данной патологией.
Под нашим наблюдением с 1990 по 1999гг. было 450 пациентов в возрасте от 15 до 77 лет, из них 235 мужчин и 215 женщин. Все они находились на лечении в отделениях реанимации больницы им. С.П. Боткина. Причинами реанимационных мероприятий у 270 больных был дорожно-транспортный травматизм, сопровождающийся множественными переломами, черепно-мозговой травмой, массивной кровопотерей и т.д. У 90 пациентов, этими причинами были производственные и бытовые травмы. Тяжелые соматические заболевания такие, как: тяжелые пневмонии, некупирующиеся приступы бронхиальной астмы и эпилепсии, нарушения мозгового кровообращения, инфаркты, патология в родах, острый панкреатит, желудочно-кишечные кровотечения, отравления и др. были у 60 пациентов. У 30 больных причиной (И) были ножевые и огнестрельные ранения жизненно важных органов.
В зависимости от сроков, прошедших после (И) все больные были разделены нами на 2 основные группы: с ранними стенозами (до 3 мес. после ИВЛ): и поздними (более 3 мес.). В первой группе было -250 больных, а во второй - 200. Такое разделение больных мы объясняли степенью патологических изменений, происходящих в гортани и трахее на фоне (И). Если в 1 группе они имели вид мягкотканных образований - "козырька" по верхнему краю трубки, грануляций, суживающих просвет гортани и трахеи, то во 2 - имели место рубцовые деформации и атрезии просвета. Поэтому тактика, длительность и эффективность лечения в группах была различной.
В каждой группе мы выделили по 3 подгруппы. Определяющим моментом для разделения был вид (И), проводимый больным. В 1 подгруппе были пациенты, перенесшие оро- или назооральную (И), -40, во 2 - (И), (Т), и впоследствии деканулированные - 130. В 3 - больные после (И), (Т), и в силу объективных причин, оставшиеся канюлярами - 280.
Уровни стенозирования в каждой подгруппе были различными. В 1 патологические изменения локализовались в складково-подскладком отделе гортани и в начальном шейном трахеи, т.е. на уровне 1-2 ее колец. Они имели вид отечного ларингита, одно или двустороннего пареза гортани, интубационной гранулемы, грануляций в подскладковом и начальном шейном отделе трахеи. Для диагностики перечисленных изменений применяли непрямую ларингоскопию, томографию гортани и шейного отдела трахеи, а также эндофиброскопическое исследование воздухопроводных путей (ЭФС).
У больных 2 подгруппы кроме отмеченных выше были зарегистрированы мягко тканный или в зависимости от сроков после (ИВЛ), рубцовый "козырек" по верхнему краю стомы, сужение передне-заднего размера шейного отдела трахеи на уровне бывшей трахеостомы, после трахеостомии по Бьерку, стенозирование грудного отдела трахеи, на месте фиксации раздувной манжетки трахеотомической трубки. Для диагностики суженных участков кроме перечисленных выше методов необходимо было провести рентгено-томографическое обследование средостения.
В третьей подгруппе у части больных была диагностирована атрезия шейного отдела трахеи от стомы до гортани, а также уровни сужения, аналогичные во 2 группе. Характер патологических изменений зависел от сроков, прошедших после (И). Лечение больных с грубыми и протяженными рубцовыми деформациями состояло из 3-4 этапов, длительность которого у некоторых пациентов составляла 4 года.
В ! группе т.е. у больных с ранними постинтубационными стенозами из 250 было 180 канюленосителей, 50 - после интратрахеальной (И) и деканулированных в профильных отделениях больницы, остальные 20 перенесли оро- или назооральную (И). При выявлении у канюленосителей воспалительных изменений в складково-подскладковом отделах гортани назначали им антибактериальную, противоотечную, десенсибилизирующую терапию, ингаляции с гидрокортизоном, физиопроцедуры на область гортани. Ежедневно меняли трахеотомические трубки с гормональной мазью. После стихания воспалительных изменений в гортани назначали фонопедическую гимнастику. Выявленные в просвете гортани или трахеи мягкотканные образования удаляли с помощью гибких эндоскопов с набором специального инструментария. Контрольное ЭФС обследование просвета гортани и трахеи проводили через 5-7 дней после удаления образований, и при отсутствии их рецидива осуществляли поэтапную декануляцию. В случаях повторного роста грануляций, суживающих просвет трахеи ниже этого уровня проводили термопластическую трубку, с которой выписывали больных для дилятации просвета на 6-8 мес.
Из 180 канюляров, лишь 10 нуждались в повторной госпитализации в отделение восстановительной ЛОР-хирургии для проведения им поэтапного хирургического лечения. После традиционного лабораторного, рентгенотомографического, эндофиброскопического обследования больных, преодоперационного осмотра терапевта и при показаниях невропатолога. За 2 дня до операции назначали пациентам внтримышечно введение антибиотиков широкого спектра действия и кровоостанавливающие препараты (дицинон или этамзилат натрия). Операцию проводили под эндотрахеальной анестезией. По отработанным в отделении методикам производили различные модификации ларинготрахеопластик, направленных на расширение суженных участков гортани и трахеи, оформляли стойкую ларинготрахеостому, в просвет которой вводили Т-образную силиконовую трубку. В послеоперационном периоде на фоне антибактериальной и гемостатической терапии добавляли противоотечную, десенсибилизирующую и анальгезирующую терапию. До 7 дня после операции ежедневно перевязывали больных со спиртом, трубку меняли на 5-7 день. Через 10-14 дней выписывали больных на 6-8 для дилятации сформированного просвета. При повторном поступлении после необходимого обследования и контрольного периода (7-10 дней без Т-трубки), при показаниях ушивали трахеальный дефект. Из-за обширных хондромаляций грудного отдела трахеи 4 пациентов остаются канюленосителями.
Пациентам, поступавшим в отделение по витальным показаниям, перенесшим длительную ИВЛ, трахеостомию и деканулированные в профильных отделениях больницы (50) после перечисленного выше обследования производили ретрахеостомию с элементами трахеопластики. Ввиду невозможности проведения им эндотрахеальной анестезии, операцию производили под местной анестезией.
Технические сложности операции были обусловлены тяжелым состоянием больного, связанного с декомпенсацией дыхания, рубцовыми изменениями тканей переднего отдела шеи, смещением трахеи от средней линии и др. У 17 пациентов после вскрытия просвета трахеи не отмечали улучшения дыхания в связи с наличием у них стеноза грудного отдела трахеи на уровне фиксации раздувной манжетки трахеотомической трубки. Уровень и степень сужения определяли с помощью гибких эндоскопов. Диаметр просвета суженного участка трахеи не превышал 3-4 мм. Расширяли трахею интубационными трубками, и в момент операции ее диаметр доводили до 7 мм. После оформления стойкой трахеостомы ниже уровня сужения проводили удлиненную термопластическую трубку или расщепленный зонд. Послеоперационное ведение больных было аналогичным описанному выше, трубку меняли ежедневно. На 2-3 после операции вводили трубку диаметром 8мм., постепенно доводили его до 10мм., после чего выписывали больных на 8-10 мес. для дилятации просвета трахеи.
Пациентам со стенозами шейного и начального грудного отдела трахеи в сформированный просвет вводили Т-образную силиконовую трубку, и на 10-14 день после операции выписывали для дилятации просвета на 6-8 мес. При повторном поступлении после проведения больным контрольного периода и традиционного обследования при показаниях ушивали трахеальный дефект. Из 50 больных полностью реабилитированы 47, трое остаются хроническими канюлярами из-за хондромаляций грудного отдела трахеи.
У пациентов, перенесших длительную оро- или назотрахеальную (И) -20 патологические изменения были зарегистрированы на уровне складково-подскладковом отделах гортани и начальном отделе трахеи.
Диагностировали перечисленные изменения при непрямой ларингоскопии боковой рентгенографии гортани и трахеи. Больным с постинтубационными гранулемами (3) произодили их эндоларингеальное удаление с помощью удаление операционного микроскопа. Остальным 17 была произведена трахеостомия под местной анестезией. Послеоперационое ведение больных не отличалось от описанного выше. Пациентов обучали самостоятельной смене трубок, и на 7-10 выписывали с рекомендацией повторного поступления в отделение через 3 месяца. На 2 этапе лечения больным производили различные варианты ларинготрахеопластик с редрессацией "печатки" перстневидного хряща, аритеноидхордэктомии и др., в сформированный просвет вводили Т-образную силиконовую трубку с закрытым верхним концом, для исключения попадания жидкой пищи в трахею. Послеоперационное ведение было традиционным, трубку меняли на 7 день при этом следили, чтобы открытый ее верхний конец был фиксирован между голосовыми складками. Больных выписывали на 14-17 после операции с рекомендацией ежедневных перевязок и еженедельной смене Т-трубок. При повторном поступлении после проведения контрольного периода и предоперационного обследования при показаниях ушивали трахеальный дефект. Все больные этой подгруппы полностью реабилитированы.
Разработанные в отделении методы диагностики и лечения больных с ранними постинтубационными стенозами гортани и трахеи позволили из 250 больных реабилитировать 243, т.е. около 95%.
У больных 2 группы с поздними (более 3 мес. прошедших после ИВЛ) постинтубационными стенозами гортани и трахеи (200) патологические изменения имели вид рубцовых деформаций, стенозов, атрезий. Больные, поступавшие в отделение с трахеотомическими трубками (100), предъявляли жалобы на афонию, невозможность дыхания без трахеотомической трубки. У 19 пациентов затрудненное дыхание при наличие трубки. При рентгенотомографическом обследовании гортани, трахеи и средостения, а также ЭФС исследовании были зарегистрированы следующие патологические изменения: срединное положение голосовых складок, как проявление анкилоза черпало-перстневидных суставов, рубцовые сужения вплоть до атрезии шейного отдела трахеи от верхнего края стомы до голосовых складок, рубцовые сужения на уровне стомы, рубцовые сужения грудного отдела трахеи на уровне фиксации раздувной манжетки трахеотомической трубки, а также по нижнему краю трахеотомической трубки. Лечение больных с затрудненным дыханием при наличии трубки начинали с расширения суженного просвета грудного отдела трахеи с помощью интубационных трубок. Дальнейшая тактика ведения больных описана выше.
Тактика хирургического лечения больных с поздними рубцовыми сужениями практически не отличалась от таковой у больных с ранними стенозами.
Устранение поздних грубых рубцовых сочетанных деформаций было более сложным, чем ранних. Сроки дилятации просвета гортани и трахеи превышали идентичные в 1 группе на 8-12 месяцев, этапность лечения увеличилась на 1-2 этапа. Из 100 больных - 17 остаются хроническими канюлярами в силу преклонного возраста (пациенты старше 70 лет) в связи с наличием у них тяжелой сопутствующей патологии - 8- больных, остальные 9 с грубыми рубцовыми деформациями грудного отдела трахеи направлены для дальнейшего лечения в отделения грудной хирургии.
Пациенты, перенесшие до поступления в отделение интубацию, трахеостомию и деканулированные (80) жаловались на затрудненное дыхание. При рентгено-томографическом и ЭФС гортани и трахеи у больных отмечены рубцовые деформации от складкового отдела гортани до грудного отдела трахеи. У большинства больных прямая ларингоскопия была не информативна, голосовая щель была у них широкой подскладковое пространство свободным.
Поэтому они нередко госпитализировались в терапевтические отделения с диагнозами обструктивный бронхит, пневмония, бронхиальная астма и. др. Лечение начинали с проведения ретрахеостомии с элементами трахеопластики. Операцию проводили под местной анестезией. В сформированный просвет вводили Т-образную силиконовую трубку, тактика послеоперационного ведения была обычной. В случаях выявления у больных стеноза грудного отдела суженные участки грудного отдела трахеи также расширяли с помощью интубационных трубок. Лечение пациентов этой подгруппы также было на 1-2 этапа больше, чем аналогичных в первой группе, а сроки дилятации грудного отдела трахеи достигали 48 мес. Из 80 больных полностью реабилитированы 70, остальные 10 остаются хроническими канюлярами из-за обширных хондромаляций грудного отдела трахеи.
У всех 20 больных, перенесших оро- или назотрахеальную интубацию зарегистрированы рубцовые деформации на уровне складково-подскладкового отдела гортани и начального отдела трахеи. Хирургическое лечение начинали с трахеостомии с последующими, описанными выше этапами лечения. Сроки лечения больных также были более длительными по сравнению с 1 группой, этапность лечения более на 1 этап. Реабилитированы все пациенты этой подгруппы. При сравнении результатов реабилитации больных с ранними и поздними стенозами гортани и трахеи выявлены следующие закономерности:
1. При переводе больных, находящихся в отделении реанимации на самостоятельное дыхание проведение ЭФС обследование позволяло выявить тенденции к стенозированию гортани и трахеи, а также своевременно их устранить с помощью гибких эндоскопов и избежать формирование рубцевания воздухопроводных путей;
2. Проведение поэтапной декануляции, динамический ЭФС контроль за состоянием просвета гортани и трахеи способствуют профилактике их стенозирования.
3. Уровень стенозирования гортани зависит от вида интубации: при назотрахеальной страдают гортань и начальный шейный отдел трахеи, при интратрахеальной (И) - шейный и грудной отделы трахеи.
4. При поступлении больных с затрудненным дыханием необходимо выявлять момент интубации.
5. Пациентам, перенесшим интубацию необходимо проводить
рентгенотомографическое трахеи и средостения, а также ЭФС гортани и трахеи.
6. Эффективность лечения больных с постинтубационными стенозами гортани и трахеи после назотрахеальной (И) составляет до 100%, что объясняется отсутствием повреждений грудного отдела трахеи.
7. Показатели реабилитации пациентов, перенесших (И), канюленосителей составили соответственно 98% и 83%, однако этапность и сроки лечения у 2 группы больных были значительно больше.
8. Показатели реабилитации больных с ранними и поздними стенозами, перенесших (И), трахеостомию и деканулированных составили 94% и 68%.
9. Невозможность полной реабилитации больных, перенесших длительную интратрахеальную интубацию объясняется развитием хондромаляций грудного отдела трахеи.
10. Успешная реабилитация больных с постинтубационными стенозами гортани и трахеи во многом зависит от совместных квалифицированных усилий реаниматологов, эндоскопистов и ЛОР-врачей.
Таблица 1. Показатели реабилитации больных с постинтубационными стенозами гортани и трахеи
No
Подгруппы больных
Больные с ранними постинтубационными стенозами гортани и трахеи
Больные с поздними постинтубационными стенозами гортани и трахеи
1
После оро-трахеальной интубации
20
20
Читайте также:


