Нейротрансплантация в лечении травмы спинного мозга

Препарат на основе двух генов поможет восстановить двигательную активность пациента после травмы спинного мозга. Революционная разработка российских ученых защищает нейроны от гибели, стимулирует рост кровеносных сосудов и новых нервных волокон. Эффективность препарата показали проведенные на крысах эксперименты — спустя несколько месяцев после начала лечения животные смогли ходить на прежде парализованных конечностях. Для того чтобы начать доклинические испытания, исследователям осталось решить проблемы с финансированием.
Травма спинного мозга, возникшая в результате аварии, несчастного случая или падения с высоты, нередко приводит к потере чувствительности и способности двигать частями тела ниже места поражения. Сейчас помочь мышцам усилить сигнал может только экзоскелет и нейропротезы, и то при условии, что не полностью утрачена связь между спинным и головным мозгом. Исследователи из Казанского федерального университета (КФУ) создали препарат, который позволяет успешно бороться с травмами спинного мозга, несмотря на наличие осложняющих выздоровление факторов.
Дело в том, что при повреждении спинного мозга организм постепенно наращивает в месте травмы рубец, состоящий из соединительной ткани. Он необходим для своеобразной фиксации места повреждения, но в дальнейшем препятствует росту аксонов, отростков нервных клеток, с помощью которых осуществляется связь с другими клетками.
Перед исследователями стояла задача создать такой препарат, который снижал бы скорость образования рубца и восстанавливал нервную ткань.
Исследователи из института фундаментальной медицины и биологии КФУ создали такой препарат, взяв за его основу два гена (VEGF и FGF2). Первый ген нормализует кровоснабжение при нейротравме, поддерживает выживаемость нейронов, стимулирует нейрогенез, рост новых сосудов и аксонов. Второй ген представляет собой фактор роста, обладает выраженным нейротрофическим действием — поддерживает выживаемость клеток в области повреждения, способствует развитию нервных волокон. Получившийся препарат содержит и регуляторные элементы, которые контролируют работу этих генов.
Испытания препарата на животных проходили следующим образом. Чтобы смоделировать повреждение спинного мозга, у подопытных вскрывали позвоночник и по нему с помощью специального молоточка наносили удар строго определенной силы. После операции животные теряли чувствительность задних конечностей и способность ими двигать. Во время всего эксперимента за животными тщательно ухаживали, помогая справляться с гигиеной и приемом пищи.
После нанесения травмы ученые переходили к лечению. Опытной группе животных вводили генный препарат, а контрольной позволяли восстанавливаться без стороннего вмешательства.
У крыс контрольной группы через два месяца после травмы наблюдалось частичное восстановление двигательных функций — животные сгибали лапы в одном или двух суставах. Однако полноценно передвигаться, удерживать вес тела и координировать движения грызуны не могли. Крысы в опытной группе в этот же период стали уверенно вставать на лапы, ходить, контролируя движения передних и задних конечностей.
— Помимо применения генного препарата мы проводим исследования эффективности лечения травм спинного мозга с помощью мезенхимных стволовых клеток, — рассказал старший научный сотрудник лаборатории генных и клеточных технологий института фундаментальной медицины и биологии КФУ Яна Мухамедшина. — Результаты обеих работ обнадеживают и показывают, что мы можем эффективно восстанавливать травмированный спинной мозг и его функции у крупных животных, в частности свиней, а в дальнейшем и у человека.
В перспективе ученые планируют сочетать эти методики для лечения травм головного мозга и терапии нейродегенеративных заболеваний.
Несмотря на то что гены в составе препарата и так присутствуют в человеческом организме, некий элемент риска всё равно есть и его невозможно предсказать, считает директор Института молекулярной медицины Научно-технологического парка биомедицины Сеченовского университета Андрей Замятнин.
— В составе генетической конструкции, которая используется, есть части (регуляторные элементы), которые в человеческом организме отсутствуют, — пояснил он. — Их влияние на организм абсолютно непредсказуемо. Поэтому для доказательства безопасности препарата необходимо провести клинические испытания.
Ученые готовы начать доклинические испытания в течение года, если решат вопрос финансирования.
Фактически сразу несколько исследовательских групп как в России, так и за рубежом трудятся над различными способами лечения паралича, вызванного инсультом или травмой спинного мозга. Благодаря инновационным протоколам лечения пациенты с хронической параплегией заново учатся ходить.
Подобные технологии позволяют стимулировать спинной мозг сверхточными электрическими импульсами, активировать нейромышечные связи ниже травмы и одновременно с этим усиливать остаточные команды от мозга.
Какие механизмы реабилитации уже существуют и могут быть использованы для лечения?
Травма спинного мозга приводит к серьезным нарушениям двигательной активности, значительно снижает качество жизни и влечет за собой значительные расходы для семей и общества. Чтобы преодолеть последствия подобных недугов, ученые стараются восстановить у парализованных людей именно способность ходить.
По мнению нейрофизиологов решающее значение для реабилитации двигательных функций имеет временное совпадение между внешней электостимуляцией и остаточной командой мозга. Так, чтобы добиться идеальной синхронизации, швейцарские ученые из Федеральной политехнической школы Лозанны (EPFL) связали расшифровку двигательного намерения мозга с подачей электросигналов для стимуляции спинного мозга через имплант.
В России подобными исследованиями занимается команда Юрия Герасименко, который много лет возглавляет Институт физиологии им. И.П. Павлова в Санкт-Петербурге. Совместно с российскими и американскими коллегами ему удалось сломать главный стереотип о параличе нижних конечностей.
Ещё лет двадцать назад считалось, что повреждения позвоночника носят анатомический характер, а движениями ног напрямую управляет головной мозг. Ученые расценивали позвоночник исключительно как проводником между мозгом и нижними конечностями и если под воздействием травмы эта связь нарушалась, то человек был вынужден навсегда пересесть в инвалидное кресло.
Но это оказалось заблуждением.
В Институте физиологии после долгих лет упорной работы сумели доказать, что учёные прошлых лет недооценивали значимость спинного мозга, и за движения нижних конечностей человека, в частности, способность ходить, отвечает именно спинной мозг.
Спинной мозг – орган центральной нервной системы, нервная трубка, находящаяся в позвоночном канале. Она делится на 31 сегмент, каждый из которых управляет своей частью тела и собирает информацию – болевую, кожную и мышечную.
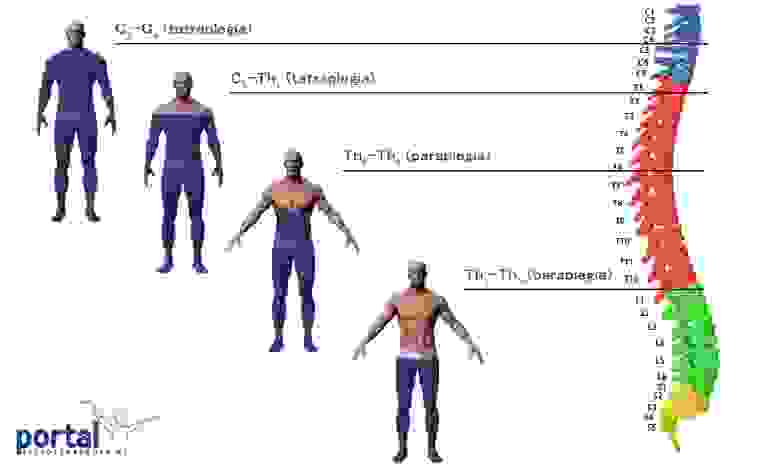
В ходе дальнейшей работы учёным удалось доказать, что поражение спинного мозга, возникающее при травме позвоночника, носит не анатомический характер, а функциональный. Следовательно, воздействуя на определенные центры, можно восстановить функцию, нарушенную травмой.
В тоже время, европейские ученые смогли далеко продвинуться в вопросе эффективности и скорости лечения. Если раньше пациенты демонстрировали прогресс только спустя несколько месяцев интенсивной реабилитации, чаще всего — примерно через год. То исследование, выполненное в Швейцарии, показало, как пациенты смогли вновь ходить (с небольшой помощью) спустя всего несколько дней. А после нескольких месяцев тренировок контролировать ранее парализованные мышцы ног даже при отсутствии электростимуляции.
Ученым пришлось подбирать отдельные параметры системы под каждого пациента. Они даже создали персонализированные модели позвоночников, находящиеся в солевом растворе, проводящем электрический ток, что позволило команде в точности определить, куда поместить электроды при последующей операции. Затем паттерны электрических сигналов были откалиброваны под каждого пациента.
Ученые отмечают, что данная техника пока еще не готова для применения в клинических условиях. Необходимо тщательно проверить все аспекты подобного лечения, в том числе его эффект на повседневную жизнь пациента за пределами госпиталя. Исследователи разработали активируемую голосом систему, которая позволяет пациенту включать и выключать эпидуральную электростимуляцию по желанию, а также выбирать один из нескольких режимов стимуляции: ходьба, езда на трицикле и т.д. Заставить имплант работать — это важная задача, но также необходимо сделать его доступной использования пациентом в повседневных условиях.

Нейротрансплантация , это использование клеточной нейротрансплантологии для восстановления нарушенных функций при различных заболеваниях головного и спинного мозга , при последствиях острых заболеваний и повреждений и при хронических прогрессирующих заболеваниях.
Цели нейротрансплантации

Возможными целями клеточной нейротрансплантации могут быть:
- замена структурно поврежденных элементов нервной ткани — нейронов, глиальных клеток, аксонов,
- трофическое обеспечение регенерации поврежденных, но структурно сохранных нейронов,
- стимуляция нейрогенеза.
Для осуществления этих целей может быть использована нейротрансплантация аутологичных клеток: фетальных, стволовых, а также периферических нервов и шванновских клеток.
Стволовые клетки , это незрелые клетки, способные к самообновлению и дифференцировке в клетки различных типов.
С целью нейротрансплантологии используются следующие клетки:
- эмбриональные стволовые,
- нервные стволовые эмбриона,
- нервные стволовые взрослого человека,
- стволовые костного мозга.
Операции в нейротрансплантологии
Перспективно использование в целях нейротрансплантации клеток структур обонятельной луковицы, содержащей комплекс прогенераторных и стволовых клеток.
Обонятельный эпителий , это единственный нейронный комплекс, непосредственно соприкасающийся с внешней средой и постоянно обновляющий рецепторные клетки, который содержит небольшое количество стволовых клеток. Пересадка этих клеток в поврежденные структуры головного или спинного мозга в силу их полипотентности может обеспечить регенерацию поврежденных нервных элементов. При использовании стволовых аутоклеток обонятельного комплекса и костного мозга отсутствуют реакция отторжения и опасность заражения вирусной инфекцией.
Помимо замещения погибших нейронов и других элементов нервной ткани делаются попытки стимуляции нейрогенеза из эндогенных стволовых клеток или клеток-предшественниц.
Имеются сведения об успехах восстановительной нейрохирургии по имплантации мезэнцефальной ткани эмбриона человека в полосатое тело при болезни Паркинсона. Показано, что имплантированные клетки могут:
- прижиться и восстановить иннервацию полосатого тела,
- высвобождать дофамин,
- функционально интегрироваться в нейрональные сети,
- приводить к клиническому улучшению (в целом пока незначительному).
При инсульте нет убедительных данных в пользу нейротрансплантации, хотя теоретически возможно улучшение функций за счет:
- высвобождения трансмиттеров и секретирования факторов роста,
- стимулирования восстановительной активности существующих нейронов,
- встраивания в нейронную и синаптическую сеть и восстановления функциональных связей.
Перспективным является трансплантация гемопоэтических и мезенхимальных стволовых аутоклеток костного мозга для лечения последствий инсульта и других заболеваний ЦНС.
В целом, оценивая ближайшие и отдаленные перспективы нейротрансплантации в восстановлении нарушенных функций при заболеваниях ЦНС, можно рассчитывать на определенные успехи реабилитационной нейротрансплантологии в лечении:
- болезни Паркинсона,
- последствий инсульта,
- последствий черепно-мозговой травмы,
- последствий спинальной травмы,
- рассеянного склероза,
- бокового амиотрофического склероза,
- сирингомиелии,
- болезни Альцгеймера.
В обсуждении вопроса об эффективности нейротрансплантации поднято несколько вопросов:
1) интервью А.С.Брюховецкого;
3) эффект от нейротрансплантации.
Вопросы можно рассмотреть с позиций:
Я тоже живу как в сказке: масс-медиа оседлали такие монстры, что грань между правдой и ложью стёрта окончательно. Но я не считаю, что дальше - страшнее. Может быть, потому что не способен оплатить вечерний эфир РТР и крепче сплю? Мне тоже непонятно, как учёному и врачу, каким образом эти клетки восстанавливают повреждённый мозг.
Цитирую понравившиеся места:
В.А. Отеллин (1999): результаты использования нейротрансплантации в клинике не так впечатляют, как в экспериментальных работах.
И.Н. Шевелёв с соавт. (2000): в спинном мозге грызунов. рост аксонов не далее 3 см. сравнительное число регенерирующих аксонов невелико. регенерирующие аксоны могут устанавливать случайные и эктопические связи, что может привести к ухудшению функциональных результатов.
М.В. Угрюмов (1999): клеточная терапия при лечении нейродегенеративных заболеваний на сегодняшнем уровне ее развития оказалась значительно менее эффективной, чем ожидалось. операции по пересадке нервной ткани больным носят экспериментальный характер и не рекомендованы для широкого применения ни в одной из западных клиник.
А.Н.Коновалов (1999): появились и продолжает появляться пугающее число сообщений о применении трансплантации эмбриональной ткани для лечения самых разнообразных заболеваний нервной системы (рассеянный склероз, боковой амиотрофический склероз, сосудистое и старческое слабоумие, последствия воспалительных заболеваний мозга, травматическая болезнь, аномалии развития и т д ), причем нервные клетки вводятся не только в пораженные участки нервной системы, но и в ликвор, кровяное русло и т. д. Никакого серьезного обоснования для использования пересадки ЭНТ при упомянутых заболеваниях нет, тем более нет никаких убедительных доказательств, что отмеченный от трансплантации эффект, если он вообще есть, действительно связан с приживлением пересаженных клеток. Более того, пересадки ЭНТ под термином метод "биоинженерной пластики мозга" переводит в среду его бесконтрольного применения, причем на первый план нередко выступают коммерческие интересы.
Рассматривая вопрос о нейротрансплантациях с позиций пациента, нельзя не учитывать вполне понятное желание выздороветь во что бы то ни стало. Устав от болезни и от постоянной борьбы с собой, человек готов поверить кому угодно, если будет обещано избавление. Да, к тому же, быстро и без лишних усилий.
С точки зрения врача просто оторопь берёт. Может быть, действительно, не нужны сложные системы реабилитации, нейрохирурги, ортопеды, урологи, не нужны инструкторы и методисты ЛФК, кинезиотерапевты, физиотерапевты, психологи, социальные работники? Неужели, наконец-то, сначала Москва, потом Россия, а затем и весь мир выдохнет с облегчением: проблема спинальной травмы РЕ-ШЕ-НА!
Давайте оставим эксперименты экспериментаторам, и займемся каждый своим делом. Для специалистов, занимающихся лечением спинальных больных, как никогда раньше, необходимо внимательно следить за всеми новыми веяниями в отрасли, не уставать учиться.
Пациентам могу посоветовать следующее. Никогда не торопитесь вытаскивать кошелёк, даже если он не Ваш. Не нужно питаться сенсациями. Любой факт, даже самый обнадёживающий, рассматривайте с разных сторон. Вот, например, и А.С.Брюховецкий пишет: нейротрансплантация эффективна и через 5, и через 20 (. ) лет после травмы. Куда мы гоним? Подождём, посмотрим.
И.Н.Шевелёв честно признаёт, что после нейротрансплантации прорастает незначительное количество волокон, но и это обнадёживает, потому что для восстановления функции их много и не надо. Правильно! А немногое их число есть у 99% спинальников! Мало, очень мало полных анатомических перерывов. Зачем тогда ещё чего-то пересаживать?
Американская певичка развлекала публику в кабаре, и её подстрелил какой-то пьяный ковбой (может быть, прапрадед Джорджа Буша?). Она долго болела, но всё-таки поправилась и вновь поднялась на сцену. Танцевать она уже не могла, поэтому только пела. Кто ищет свою судьбу, тот её найдёт. Через несколько лет вторая пуля догнала стойкую леди и уложила навечно. На вскрытии был выявлен полный анатомический перерыв спинного мозга во время первого ранения. Как же она ходила, с полным перерывом? А ей никто не сказал.
Мы все ждём чуда, ищем чудеса везде, где только можно. Между тем, чудеса есть, они вокруг нас и внутри нас. Мы затёрли до дыр слова, что болезнь это испытание, и уже не понимаем их смысла. Временная или стойкая обездвиженность, любая тяжёлая болезнь - не только стимул для поиска путей к исцелению, но и повод задуматься над совершенствованием себя, телесно и духовно, если мысли об этом не приходили раньше. Ни одна система упражнений, ни одна операция не даст эффект, если не вписывается в Ваш жизненный сценарий.
Все спинальники, даже с одинаковой травмой, живут по-разному: одни глушат водку и гниют в коляске, другие зарабатывать свой второй миллион, третьи растут сами и помогают другим, попавшим в беду.
Оценено применение специализированных шкал и опросников для выявления центрального компонента невропатического болевого синдрома у пациентов с травмой спинного мозга (ТСМ). Индивидуализированная дифференцированная терапия - эффективный способ борьбы с бол
Use of special scales and questionnaires was evaluated, to reveal central component of neuropathic pain syndrome in patients with spinal cord injury (SCI). Individualized varied therapy is an effective way of pain syndrome combating in patients having SCI.
.jpg)
Травма спинного мозга (ТСМ) — классическая модель невропатического болевого синдрома. На уровне травмы зачастую возникает периферическая невропатическая боль, связанная с повреждением корешков спинного мозга, в то время как невропатический болевой синдром, возникающий ниже уровня повреждения спинного мозга, можно уверенно назвать центральным.
N. M. Finnerup и соавт. указали на роль повреждения серого вещества спинного мозга в патогенезе болей ниже уровня повреждения. Согласно результатам клинических исследований, в отличие от пациентов без боли, у пациентов с болями ниже уровня травмы общим патологическим признаком является повреждение серого вещества спинного мозга [8].
Предметом особого внимания является участие структур супраспинального уровня в механизмах развития болевого синдрома. Выявлено значительное усиление кровотока в дугообразном ядре гипоталамуса, в корковом представительстве нижних конечностей, в коре теменной доли, в заднем, медиальном и латеральном ядрах таламуса [9]. Показана важная роль таламуса в механизмах возникновения центральной боли [10, 11]. В литературе есть указания на функциональную реорганизацию таламуса после повреждения спинного мозга [12, 13]. Вместе с тем остается открытым вопрос о связи процессов в таламусе после ТСМ с развитием болевого синдрома [11, 14]. Существует гипотеза, что снижение возбуждающих или повышение ингибирующих влияний на латеральные отделы таламуса порождают порочный круг, включающий медиальные отделы и ретикулярное ядро таламуса, а их проекция на кору может участвовать в восприятии боли [15].
Так как патофизиология боли ниже уровня повреждения имеет как спинальные, так и супраспинальные компоненты, включая таламус и кору полушарий, на экспериментальных моделях ведется поиск методов, которые позволили бы оценить болевой синдром при поражениях нервной системы на разных уровнях [18, 19].
Нами было обследовано 45 пациентов, оперированных по поводу позвоночно-спинномозговой травмы в период с 2003 по 2008 гг. Соотношение мужчин и женщин составило 1,81:1 (29 мужчин и 16 женщин). Средний возраст пациентов — 32,6 ± 8,2 года.
В работе применялись следующие критерии выделения компонентов боли:
1) невропатический компонент, который отмечался при локализации боли в зоне соматосенсорного дефицита и наличии в ней позитивных и/или негативных сенсорных симптомов;
2) ноцицептивный компонент боли, который выражался в суставном, вертебральном, мышечно-тоническом, миофасциальном синдромах;
3) психогенный компонент, выделяемый при наличии болевого синдрома, который не мог быть адекватно объяснен ноцицептивным и невропатическим механизмами, а его течение имело связь с психическим состоянием пациента.
Для оценки интенсивности болевого синдрома использовалась визуальная аналоговая шкала (ВАШ). Качественные характеристики боли оценивались при помощи Мак-Гилловского болевого опросника. Для оценки тяжести болевого синдрома, его влияния на качество жизни пациентов, а также оценки эффективности терапии применялся Краткий опросник боли.
Для выявления и оценки невропатического компонента боли применялась шкала LANSS и опросник DN4.
Исходно всем включенным в исследование пациентам проводилось неврологическое и клинико-психологическое обследование, оценка характеристик болевого синдрома и эффективности терапии на момент включения в исследование.
Пациентам с болевым синдромом при их согласии назначали индивидуализированную дифференцированную терапию (ИДТ) с учетом типа и характера болевого синдрома. Динамику болевого синдрома на фоне ИДТ в данной группе больных оценивали через 3 месяца.
При неврологическом обследовании нижний спастический парапарез отмечался у 42,2% пациентов, нижний вялый парапарез — у 35,6%, тетрапарез был выявлен у 11,1% больных. Синдром Броун-Секара был представлен в 4,4% случаев. У 2,2% пациентов выявлялся вялый парез левой и спастический правой нижней конечности, у 4,4% — вялый парез правой и спастический левой нижней конечности
Наиболее часто поражались грудные сегменты спинного мозга (35,6%) и корешки конского хвоста (22,2%). У части пациентов отмечалось сочетанное поражение спинного мозга и корешков на разных уровнях: у 13,3% пациентов — на поясничном уровне, у 11,1% — на грудном и у 6,7% — на шейном.
У всех пациентов отмечались расстройства поверхностной и глубокой чувствительности, как изолированные, так и в различных сочетаниях.
Болевой синдром невропатического характера всегда сопровождался нарушениями чувствительности соответствующей локализации, однако нарушения чувствительности не обязательно сопровождались болевым синдромом.
Распространенность болевого синдрома среди обследованных пациентов составила 86,7%. Средняя интенсивность боли по ВАШ составила 5,36 ± 1,65, тяжесть боли 4,16 ± 1,51, влияние боли на качество жизни 3,93 ± 2,20. Данные цифры свидетельствуют о выраженном болевом синдроме у обследованных пациентов.
У 30 (76%) пациентов боль носила смешанный характер (ноцицептивная + невропатическая, ноцицептивная + психогенная, невропатическая + психогенная, ноцицептивная + невропатическая + психогенная). У 5 (13%) пациентов наблюдался изолированный невропатический компонент боли, у 3 (8%) — ноцицептивный и у 1 (3%) — психогенный.
Периферическая невропатическая (корешковая) боль отмечалась у 61,5% пациентов и была связана с травмой или компрессией корешков спинного мозга, центральная (проводниковая) — у 30,8%, вследствие повреждения проводников болевой чувствительности, сегментарная — у 17,9% пациентов, что было связано с повреждением задних рогов спинного мозга. У пациентов с ноцицептивным компонентом болевого синдрома преобладали вертеброгенные боли (69,2%), у 20,5% — отмечалась боль, обусловленная спастичностью, у 10,3% — боль от вторичной перегрузки плечевых суставов. У 48% пациентов был выявлен психогенный компонент боли.
При сравнении пациентов с центральным и периферическим компонентом невропатического болевого синдрома достоверно более высокая интенсивность и тяжесть боли (p 5 баллов по ВАШ) боли. Схожая статистика приводится и в литературе. Так, по данным Tasker и соавт., распространенность хронической боли после ТСМ достигает 94%, а в 50% случаев отмечается высокая интенсивность боли [6]. В исследовании, проведенном на 237 пациентах, P. J. Siddall и соавт. отмечали нарастание интенсивности болевого синдрома в течение 5 лет после ТСМ [20].
Более высокая интенсивность центральной невропатической боли по сравнению с периферической подтверждается литературными данными. По данным M. P. Jensen и соавт., центральная боль отличается более высокой интенсивностью, хуже переносится пациентами и хуже откликается на противоболевую терапию [21].
Многочисленные исследования продемонстрировали, что повреждение проводящих путей болевой чувствительности играет важную роль в возникновении центральной невропатической боли. В соответствии с данными других авторов [22, 23], наше исследование показало, что повреждение спиноталамического тракта часто, но не всегда, приводит к развитию невропатической боли, поскольку проводниковые нарушения чувствительности отмечаются у пациентов с ТСМ и при отсутствии болевого синдрома. Отсутствие прямой зависимости между степенью повреждения соматосенсорной системы и выраженностью болевого синдрома является характерной особенностью как центральной, так и периферической невропатической боли [24].
По результатам нашего исследования не было выявлено корреляции между интенсивностью болевого синдрома и локализацией боли, однако отмечалась взаимосвязь, хотя и не достигавшая уровня статистической значимости, между интенсивностью боли и ее локализацией по отношению к уровню травмы. Так, в верхней части туловища и руках боль была менее выражена, чем в ногах. Эти данные соотносятся с работой Sidall и соавт., которые в своем исследовании отметили, что боль, возникающая ниже уровня травмы, характеризуется пациентами как более выраженная, в то время как боль выше уровня травмы переносится легче [20]. Такой результат, по всей видимости, обусловлен преобладанием центрального невропатического компонента болевого синдрома ниже уровня травмы.
Показанная в нашем исследовании высокая эффективность ИДТ у 47% пациентов, по всей видимости, была обусловлена оптимальным набором препаратов для лечения болевого синдрома, а также высокой комплаентностью пациентов. Применение прегабалина (Лирика) у данной группы больных позволило существенно снизить интенсивность болевого синдрома, повысить качество жизни пациентов и снизить уровень тревожности.
Высокая эффективность прегабалина, в отношении центрального невропатического болевого синдрома, подтверждается результатами многоцентрового, рандомизированного, плацебо-контролируемого исследования [25]. В исследовании оценивалась эффективность прегабалина в отношении невропатической боли у пациентов с травмой спинного мозга. Прегабалин показал достоверно более высокую эффективность в отношении снижения интенсивности болевого синдрома, улучшения сна, уменьшения уровня тревожности.
Сравнительно низкая эффективность ИДТ болевого синдрома у 53% пациентов, возможно, связана с недостаточным эффектом от применения антидепрессантов в терапии центрального невропатического болевого синдрома и/или недостижением целевых доз препарата, вследствие развития побочных эффектов, недооценки психогенного компонента боли и/или краткости исследования, а также с низкой приверженностью пациентов к лечению.
Наше исследование имело ряд ограничений. Одним из важнейших является короткий период наблюдения, что не позволило в некоторых случаях достигнуть оптимальной дозировки лекарственных препаратов, а также оценить продолжительность анальгезирующего эффекта ИДТ.
Результаты нашего исследования демонстрируют чрезвычайную важность применения специализированных шкал и опросников для своевременного выявления центрального компонента невропатического болевого синдрома у пациентов с ТСМ, так как его наличие обуславливает интенсивность и тяжесть боли, оказывает существенное влияние на качество жизни пациентов. ИДТ, подобранная с учетом типа и характера боли, является эффективным способом борьбы с болевым синдромом у пациентов с ТСМ. Прегабалин должен применяться в качестве базового препарата при лечении центральной боли у пациентов с ТСМ. Болевой синдром у пациентов с травмой спинного мозга до конца не изучен и требует дальнейших исследований для уточнения патофизиологических характеристик боли и подбора наиболее эффективных терапевтических стратегий.
Литература
- Bowsher D. Central pain: clinical and physiological characteristics // J Neurol Neurosurg Psychiatry. 1996. Vol. 61. P. 62–69.
- Defrin R., Ohry A., Blumen N., Urca G. Characterization of chronic pain and somatosensory function in spinal cord injury subjects // Pain. 2001. Vol. 89. P. 253–263.
- Yezierski R. P. Spinal Cord Injury: A Model of Central Neuropathic Pain // Neurosignals. 2005. Vol. 14. P. 182–193.
- Beric A., Dimitrijevic M. R., Lindblom U. Central dysesthesia syndrome in spinal cord injury patients // Pain. 1988. Vol. 34. P. 109–116.
- Pagni C. A. Central pain due to spinal cord and brain stem damage. In: Wall PD, Melzack R, ed. Textbook of Pain // Churchill Livingston, Edingburg. 1989. P. 634–655.
- Tasker R. Pain resulting from central nervous system pathology (central pain). In: Bonica J. J. Ed. The Management of Pain. Lea & Febiger, Philadelphia. 1990. P. 264–283.
- Craig A. D., Bushnell M. C. The thermal grill illusion: unmasking the burn of cold pain // Science. 1994. Vol. 265. P. 252–255.
- Finnerup N. B., Johannesen I. L., Sindrup S. H. et al. Pain and dysesthesia in patients with spinal cord injury: a postal survey // Spinal Cord. 2001. Vol. 39. № 5. P. 256–62.
- Morrow T. J., Paulson P. E., Brewer K. L. et al. Chronic, selective forebrain responses to excitotoxic dorsal horn injury // Exp Neurol. 2000. Vol. 161. P. 220–226.
- Полушкина Н. Р., Яхно Н. Н. Центральная постинсульная боль. Клинические, психологические и терапевтические аспекты // Неврологический журнал. 1998. Т. 3. № 2. С. 13–17.
- Dostrovsky J. O. Role of thalamus in pain // Prog Brain. Res. 2000. Vol. 129. P. 245–257.
- Hirayama T., Dostrovsky J. O., Gorecki J., Tasker R. R., Lenz F. A. Recordings of abnormal activity in patients with deafferentation and central pain // Stereotact Funct Neurosurg. 1989. Vol. 52. P. 120–126.
- Jeanmonod D., Magnin M., Morel A. Thalamus and neurogenic pain: physiological, anatomical and clinical data // Neuroreport. 1993. Vol. 4. P. 475–478.
- Jensen T. S., Lenz F. A. Central post-stroke pain: a challenge for the scientist and the clinician. Pain. 1995. Vol. 61. P. 161–164.
- Jeanmonod D., Magnin M., Morel A. Low-threshold calcium spike bursts in the human thalamus. Common physiopathology for sensory, motor and limbic positive symptoms // Brain. 1996. Vol. 119. P. 363–375.
- Melzack R. Phantom limbs and the concept of a neuromatrix // Trends Neurosci. 1990. Vol. 13. P. 88–92.
- Canavero S., Bonicalzi V., Pagni C. A. et al. Propofol analgesia in central pain — preliminary clinical observations // J Neurol. 1995. Vol. 242. Р. 561–567.
- Mauderli A. P., Acosta-Rua A., Vierck C. J. A conscious behavioral assay of thermal pain in rodents // J Neurosci Methods. 2000. Vol. 97. P. 19–29.
- Vierck C. J., Light A. R. Allodynia and hyperalgesia within dermatomes caudal to a spinal cord injury in primates and rodents // Progr Brain Res. 2000. Vol. 129. P. 411–428.
- Siddall P. J., Middleton J. W. A proposed algorithm for the management of pain following spinal cord injury // Spinal Cord. 2006. Vol. 44. P. 67–74.
- Jensen M. P., Hoffman A. J., Cardenas D. D. Chronic pain in individuals with spinal cord injury: a survey and longitudinal study // Spinal Cord. 2005. Vol. 43. № 12. P. 704–712.
- Defrin R., Ohry A., Blumen N., Urca G. Characterization of chronic pain and somatosensory function in spinal cord injury subjects // Pain. 2001. Vol. 89. P. 253–263.
- Eide P. K., Stubhaug A., Stenehjem A. E. Central dysesthesia pain after traumatic spinal cord injury is dependent on Treatment algorithm for SCI pain PJ Siddall and JW Middleton N-methyl-D-aspartate receptor activation // Neurosurgery. 1995. Vol. 37. P. 1080–1087.
- Данилов А. Б., Давыдов О. С. Нейропатическая боль. М.: Боргес. 2007. 75 с.
- Siddall P. J., Cousins M. J., Otte A. et al. Pregabalin in central neuropathic pain associated with spinal cord injury: a placebo-controlled trial // Neurology. 2006. Vol. 28. P. 1792–800.
П. Я. Бранд, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Читайте также:


