Лечение травмы спинного мозга стволовыми клетками в россии

Препарат на основе двух генов поможет восстановить двигательную активность пациента после травмы спинного мозга. Революционная разработка российских ученых защищает нейроны от гибели, стимулирует рост кровеносных сосудов и новых нервных волокон. Эффективность препарата показали проведенные на крысах эксперименты — спустя несколько месяцев после начала лечения животные смогли ходить на прежде парализованных конечностях. Для того чтобы начать доклинические испытания, исследователям осталось решить проблемы с финансированием.
Травма спинного мозга, возникшая в результате аварии, несчастного случая или падения с высоты, нередко приводит к потере чувствительности и способности двигать частями тела ниже места поражения. Сейчас помочь мышцам усилить сигнал может только экзоскелет и нейропротезы, и то при условии, что не полностью утрачена связь между спинным и головным мозгом. Исследователи из Казанского федерального университета (КФУ) создали препарат, который позволяет успешно бороться с травмами спинного мозга, несмотря на наличие осложняющих выздоровление факторов.
Дело в том, что при повреждении спинного мозга организм постепенно наращивает в месте травмы рубец, состоящий из соединительной ткани. Он необходим для своеобразной фиксации места повреждения, но в дальнейшем препятствует росту аксонов, отростков нервных клеток, с помощью которых осуществляется связь с другими клетками.
Перед исследователями стояла задача создать такой препарат, который снижал бы скорость образования рубца и восстанавливал нервную ткань.
Исследователи из института фундаментальной медицины и биологии КФУ создали такой препарат, взяв за его основу два гена (VEGF и FGF2). Первый ген нормализует кровоснабжение при нейротравме, поддерживает выживаемость нейронов, стимулирует нейрогенез, рост новых сосудов и аксонов. Второй ген представляет собой фактор роста, обладает выраженным нейротрофическим действием — поддерживает выживаемость клеток в области повреждения, способствует развитию нервных волокон. Получившийся препарат содержит и регуляторные элементы, которые контролируют работу этих генов.
Испытания препарата на животных проходили следующим образом. Чтобы смоделировать повреждение спинного мозга, у подопытных вскрывали позвоночник и по нему с помощью специального молоточка наносили удар строго определенной силы. После операции животные теряли чувствительность задних конечностей и способность ими двигать. Во время всего эксперимента за животными тщательно ухаживали, помогая справляться с гигиеной и приемом пищи.
После нанесения травмы ученые переходили к лечению. Опытной группе животных вводили генный препарат, а контрольной позволяли восстанавливаться без стороннего вмешательства.
У крыс контрольной группы через два месяца после травмы наблюдалось частичное восстановление двигательных функций — животные сгибали лапы в одном или двух суставах. Однако полноценно передвигаться, удерживать вес тела и координировать движения грызуны не могли. Крысы в опытной группе в этот же период стали уверенно вставать на лапы, ходить, контролируя движения передних и задних конечностей.
— Помимо применения генного препарата мы проводим исследования эффективности лечения травм спинного мозга с помощью мезенхимных стволовых клеток, — рассказал старший научный сотрудник лаборатории генных и клеточных технологий института фундаментальной медицины и биологии КФУ Яна Мухамедшина. — Результаты обеих работ обнадеживают и показывают, что мы можем эффективно восстанавливать травмированный спинной мозг и его функции у крупных животных, в частности свиней, а в дальнейшем и у человека.
В перспективе ученые планируют сочетать эти методики для лечения травм головного мозга и терапии нейродегенеративных заболеваний.
Несмотря на то что гены в составе препарата и так присутствуют в человеческом организме, некий элемент риска всё равно есть и его невозможно предсказать, считает директор Института молекулярной медицины Научно-технологического парка биомедицины Сеченовского университета Андрей Замятнин.
— В составе генетической конструкции, которая используется, есть части (регуляторные элементы), которые в человеческом организме отсутствуют, — пояснил он. — Их влияние на организм абсолютно непредсказуемо. Поэтому для доказательства безопасности препарата необходимо провести клинические испытания.
Ученые готовы начать доклинические испытания в течение года, если решат вопрос финансирования.
Выполняется хирургическая операция, направленная на разрушение интрамедуллярной кисты и заполнение дефекта фибриновым гелем, содержащим низкодифференцированные (стволовые) клетки. Дальнейшее лечение включает одну или несколько субарахноидальных клеточных трансплантаций.
Первоначальный этап лечения занимает 20-25 дней. Схема последующего лечения строится в зависимости от изменений в неврологическом статусе пациента. Лечение проводится в условиях нейрохирургического отделения.
Трансплантированные клетки продуцируют нейротрофические факторы, стимулирующие аксональный рост, а также непосредственно участвуют в восстановлении нарушенных нервных коммуникаций.
Клеточный трансплантат проходит 3-уровневое тестирование, которое включает в себя два иммуноферментных анализа и одно ПЦР- тестирование.
Возможны хирургические осложнения. В отдаленном периоде осложнений не зарегистрировано.
Клеточная технология лечения спинальной травмы
В ЦИКТ разработана оригинальная технология лечения спинальной травмы, основанная на трансплантация незрелых (стволовых) клеток непосредственно в место повреждения спинного мозга (патент РФ № 2195941). Специальные исследования позволили определить комбинацию клеток оптимальную для запуска процессов репарации нервной ткани. Технология лечения состоит из трех этапов. На первом этапе жизнеспособные клетки помещаются в специальный гель, создающий благоприятное микроокружение для клеточного роста. На втором этапе выполняется операция, обеспечивающая доступ к дефекту спинного мозга (см. рисунок 1).
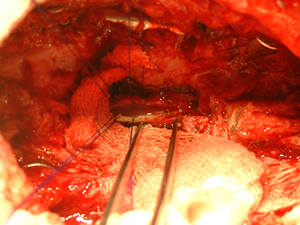
Рисунок 1. Вскрытие внутримозговой кисты и выделение дефекта спинного мозга.
На заключительном этапе, дефект спинного полностью заполняется клеточным трансплантатом (см. рисунок 2).
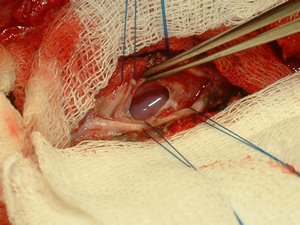
Рисунок 2. Заполнение дефекта спинного мозга клеточным трансплантатом.
Дальнейшее лечение включает в себя субарахноидальные клеточные трансплантации, назначение которых усилить клинический эффект трансплантационного лечения.
В настоящее время трансплантационное лечение проведено 122 пациентам.
Степень неврологических нарушений оценивалась по международной шкале ASIA.
Результаты лечения пациентов со сроком наблюдения не менее 2 лет показаны в таблице 1.
Таблица 1. Результаты лечения пациентов.
| Исходный неврологический статус (до лечения) | Неврологический статус после лечения (% пациентов) | |||
|---|---|---|---|---|
| A | B | C | D | |
| A (73 пациента - 100%) | 31% | 48% | 18% | 3% |
| B (49 пациентов -100%) | - | 78% | 22% | - |
A — полное нарушение двигательных и чувствительных функций ниже уровня повреждения;
B — полное нарушение двигательных функций (возможно наличие сократительной активности в отдельных мышцах), неполное нарушение чувствительные функции ниже уровня повреждения;
С — неполное нарушение двигательных и чувствительных функций ниже уровня повреждения, в большинстве мышц сила менее 3 баллов;
D — неполное нарушение двигательных функций, в большинстве мышц сила более 3 баллов.
Согласно полученным данным, неврологические улучшения разной степени выраженности отмечаются более, чем у половины пролеченных пациентов. Известно, что при стандартных методах лечения восстановление функций спинного мозга обычно прекращается через 1 год после травмы. Обусловленные клеточной терапией улучшения неврологического статуса пациентов начинают появляться, как правило, не ранее, чем через 6 месяцев и развиваются постепенно в течении длительного периода времени (3 лет и более). Поэтому, приведенные данные не являются окончательными, они будут меняться с течением времени. Эффекты трансплантационного лечения являются устойчивыми — случаев их реверсии отмечено не было. Осложнений, связанных с функциональной активностью трансплантированных клеток, зарегистрировано не было.
Таким образом, клеточная технология открывает новые возможности для эффективного лечения пациентов с последствиями спинальной травмы, которые с позиции стандартной медицины считаются инкурабельными.
Примеры применения клеточной технологии приведены ниже.
Пациент А, 31 год, во время прыжка с парашютом получил позвоночно-спинномозговую травму на уровне Th12-L1. Давность травмы к моменту начала трансплантационного лечения 1.5 года.
Состояние до трансплантационного лечения: нижний парапарез (отсутствие самопроизвольных движений, сила до 2 баллов); глубокое нарушение всех видов чувствительности с уровня паховой складки; нарушение функций тазовых органов.
Лечение: операция (разрушение кисты и имплантация клеточного трансплантата) плюс 1 субарахноидальная клеточная трансплантация.
Через 6 месяцев после лечения: все виды чувствительности и функции тазовых органов восстановлены, пациент самостоятельно осуществляет сгибание в тазобедренных и коленных суставах обеих ног и удерживает их в согнутом положении (см. рисунок 3).

Рисунок 3. Пациент А самостоятельно осуществляет сгибание ног и удерживает их в согнутом положении.
По данным нейромиографии в нижних конечностях регистрируется появление отчетливой проводимости биопотенциалов (см. рисунок 4).
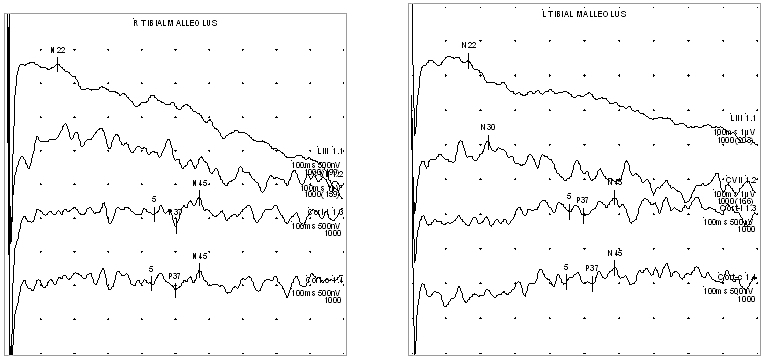
Рисунок 4. Электромиографическое исследование нижних конечностей пациента А.
Пациент З, 24 года, во время падения с высоты получил травму спинного мозга на уровне сегмента С7. Давность травмы к моменту начала трансплантационного лечения 2 месяца.
Состояние до трансплантационного лечения: верхний парапарез (сила в дистальных отделах рук до 2 баллов), нижняя вялая параплегия; нарушение всех видов чувствительности с Th1 сегмента по проводниковому типу; мочеиспускание через цистостому. Режим — постоянно постельный. По данным МРТ: cпинной мозг на уровне С3- Th3 сегментов истончен, его оболочки утолщены, непрерывность сохранена; на уровне С7 сегмента визуализируется интрамедуллярная киста размером 1.0 × 0.2 см; (см. рисунок 5 A).
Лечение: операция (разрушение интрамедуллярной кисты и имплантация клеточного трансплантата в дефект спинного мозга) плюс 2 cубарахноидальные клеточные трансплантации.
Через 120 дней после трансплантационного лечения по данным МРТ в месте, где ранее визуализировалась киста, были видны участки различной плотности (см. рисунок 5 B). Возможно, эти участки являлись видимым проявлением регенеративной активности трансплантированных клеток. Через 4 года видимых признаков повреждения спинного мозга обнаружено не было (см. рисунок 5 C)
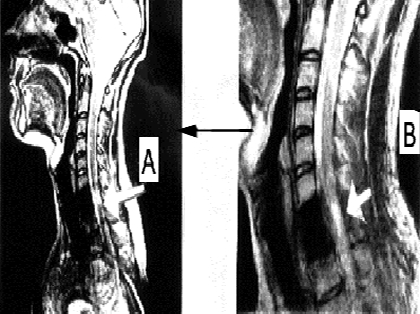
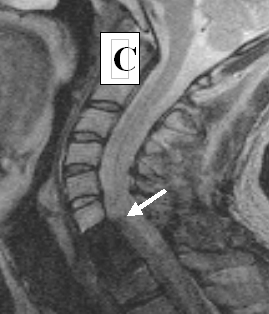
Рисунок 5. (А, B, C). МРТ - изображение пациента З до лечения (А), через 4 месяца (В) через 4 года (С) после трансплантационного лечения.
Изменения в неврологическом статусе пациента развивались постепенно в течение 4 лет (см. таблицу 2).
Таблица 2. Динамика изменений в неврологическом статусе пациента З.
| Время после лечения (годы) | Клинические признаки | ||||
|---|---|---|---|---|---|
| Сила в кистях (балл) | Объем движений в пальцах кисти | Объем движений в ногах | Уровень болевой чувствительности | Мочеиспускание | |
| 0.5 | 2 | Нет | Нет | Th 2-Th3 | Недержание |
| 1 | 2 | Сгибание, разведение | 1 палец правой стопы | Th 6-7, мышечно-суставное чувство | Контролирует в диапазоне 3-4 часов |
| 2 | 3-4 | Сгибание, разведение | Сокращение отдельных групп мышц бедер | Полное восстановление всех видов чувствительности | Полное восстановление функции |
| 4 | 5 | Полный объем | Сокращения мышц голени | Полное восстановление всех видов чувствительности | Полное восстановление функции |
В конечном итоге: все виды чувствительности восстановлены; функции тазовых органов полностью контролируемые; сила в дистальных отделах рук 5 баллов c обеих сторон; присутствует двигательная активность в нижних конечностях: пациент может стоять и передвигаться с опорой (см. рисунок 6).
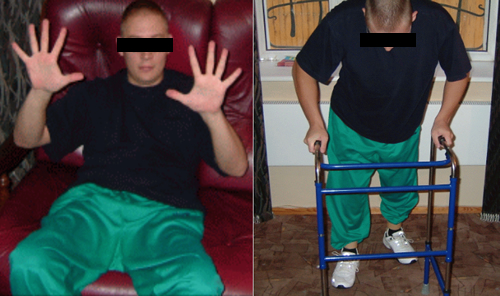
Рисунок 6. Пациент З полностью восстановил двигательную активность в руках, передвигается с опорой.
Пациент Т, 25 лет во время автокатастрофы получил взрывной перелом Th 6 позвонка с компрессией спинного мозга. К моменту начала трансплантационного лечения давность травмы составляла 4 месяца.
Состояние до трансплантационного лечения: нижняя вялая параплегия; глубокое нарушение всех видов чувствительности с сегмента Th5 по проводниковому типу; мочеиспускание через цистостому. По данным МРТ на уровне Th 6 сегмента обнаружена интрамедуллярная киста размером 3.0 × 0.5 см; на уровне Th7-Th9 спинной мозг неоднороден по структуре, определялись участки размером до 0.7 см, имеющие повышенную интенсивность в режиме T2.
Лечение: операция (разрушение кисты и имплантация клеточного трансплантата в место спинального дефекта) плюс 2 субарахноидальные клеточные трансплантации. Состояние через 2 года после лечения: все виды чувствительности восстановлены полностью; восстановлены функций тазовых органов; пациент обслуживает себя в полной мере, передвигается самостоятельно без костылей и посторонней помощи.
Пациент К, 52 года, в результате автодорожной аварии получил спинальную травму на уровне С3-С6 позвонков.
Состояние до трансплантационного лечения: синдром полного перерыва спинного мозга: тетраплегия, нарушение всех видов чувствительности с С5 сегмента, нарушение функций тазовых органов. На МРТ: на протяжении от С2 до С5 сегментов в центральных отделах спинного мозга определялся очаг ушиба размером 5.8 × 0.3 см с кистообразованием (см. рисунок 7 А).
Лечение: три субарахноидальные клеточные трансплантации с интервалом в 14 дней.
Через 44 дня после клеточной трансплантации на МРТ в месте ушиба визуализировалось гетерогенное образование (возможно киста с клеточным содержимым) (см. рисунок 7 B). Через 4 года видимых признаков повреждения спинного мозга обнаружено не было (см. рисунок 7 С);
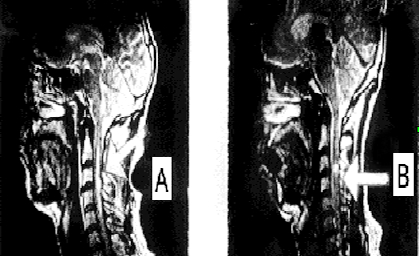
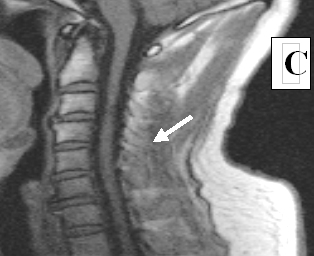
Рисунок 7. МРТ изображение пациента К до лечения (А), через 44 дня (B) и 4 года (С) после трансплантационного лечения.
В течение 4 лет у больного постепенно происходило восстановление функций спинного мозга. В конечном итоге: все виды чувствительности и функции тазовых органов восстановлены в полной мере; сила в руках достигает 5 баллов; уровень двигательной активности в нижних конечностях позволяет пациенту передвигаться с посторонней помощью без опоры (см. рисунок 8). Пациент полностью обслуживает себя, работает на компьютере.
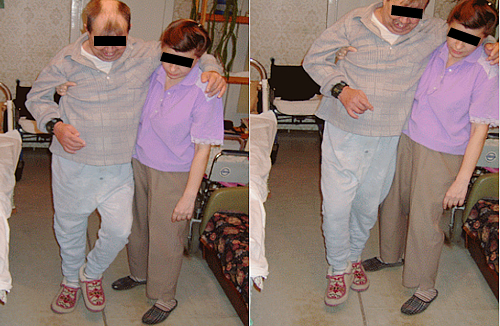
Рисунок 8. Пациент К ходит с посторонней помощью без дополнительных приспособлений.
Пациент С., 18 лет, во время ныряния в воду получил колиновидный перелом-вывих С5 позвонка. Давность травмы к моменту начала трансплантационного лечения 1.5 года.
Состояние до трансплантационного лечения: тетраплегия с нарушениями всех видов чувствительности с Th1 сегмента и задержкой мочеиспускания. По данным МРТ выявлена интрамедуллярная киста на уровне С5-С6 сегментов, перекрывающая на ¾ поперечник спинного мозга (см. рисунок 9 А).
Лечение: операция (разрушение кисты и имплантация клеточного трансплантата) плюс 2 субарахноидальные клеточные трансплантации.
Через 2 года после лечения: сила в кистях 4 балла; присутствует тактильная чувствительность и мышечно-суставное чувство справа; отмечено активное сокращение мышц бедер; мочеиспускание самостоятельное, контролируемое; пациент способен работать на компьютере, может стоять на коленях, опираясь руками об пол. На МРТ отмечено отсутствие интрамедуллярной кисты и восстановление целостности спинного мозга (см. рисунок 9).
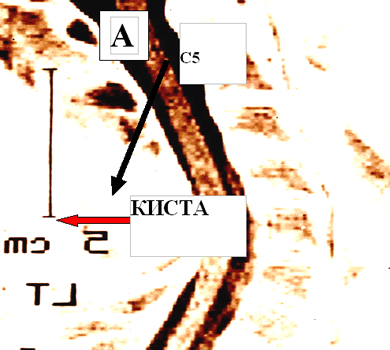
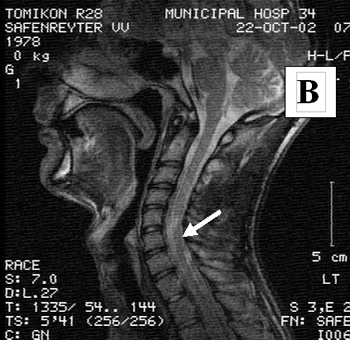
Рисунок 9. МРТ изображение пациента С до (А) и через 2 года (В) после трансплантационного лечения.
Пациент В, 23 года, получил травму спинного мозга на уровне сегмента С5 в результате автодорожной катастрофы. К моменту начала трансплантационного лечения давность травмы 3 года.
Состояние до трансплантационного лечения: верхний парапарез (сила в дистальных отделах рук до 2 баллов), нижняя параплегия; нарушение всех видов чувствительности ниже уровня поражения; нарушение функции тазовых органов. По данным МРТ на уровне поражения визуализировалась киста.
Лечение: операция (разрушение кисты и имплантация клеточного трансплантата) плюс 1 субарахноидальная клеточная трансплантация.
Состояние через 1.5 года после лечения: На МРТ место, где ранее визуализировалась киста, большей частью заполнено нервной тканью (см. рисунок 10); чувствительность и функции тазовых органов восстановлены; сила в правой руке 5 баллов, в левой 3 балла; может писать, работать на компьютере, водить автомобиль (см. рисунок 11).
Рисунок 10. МРТ изображение пациента В через 1.5 года после трансплантационного лечения.


Рисунок 11. Пациент В пишет, работает на компьютере, водит автомобиль.
Пациентка К, 18 лет, получила повреждение спинного мозга на уровне С6 вследствие автодорожной катастрофы. К моменту начала трансплантационного лечения давность травмы 2 года.
Состояние до трансплантационного лечения: верхний парапарез (сила до 2 баллов), нижняя параплегия; нарушение всех чувствительности ниже уровня поражения; нарушение функции тазовых органов.
Лечение: операция (разрушение кисты и имплантация клеточного трансплантата) плюс 2 субарахноидальные клеточные трансплантации.
Cостояние через 1 год после лечения: чувствительность и функций тазовых органов восстановлены полностью; может пользоваться столовыми приборами, писать, вязать, рисовать картины, стоять с опорой, передвигаться в фиксирующих ходунках (см. рисунок 12).
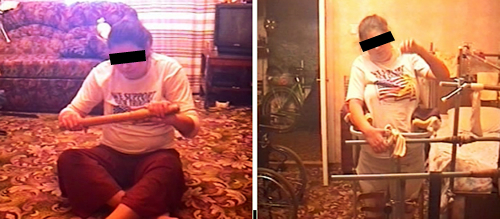
Рисунок 12. Пациентка К полностью восстановила двигательную активность в руках, способна стоять с опорой и передвигаться в фиксирующих ходунках.
Не всегда врачи могут сразу определить, приходится ли им иметь дело с полным либо с частичным повреждением. При частичном повреждении спинной мозг может передавать некоторые сигналы в головной мозг и наоборот, поэтому такие пациенты обладают некоторой чувствительностью и даже некоторыми моторными функциями ниже пораженной области.
Полное повреждение спинного мозга сопровождается полной или почти полной потерей моторной функции и чувствительности ниже области поражения. И хотя даже при тяжелой травме спинной мозг почти никогда не является полностью перерезанным, обширность повреждения приводит к тому, что восстановление пациента становится делом практически безнадежным. Во всяком случае, так считалось до сравнительно недавнего времени.
Несколько фактов

Больница Крейга в штате Колорадо, США, специализирующаяся на лечении и реабилитации пациентов с параличом, предлагает на своем сайте несколько фактов, позволяющих больным и их близким сориентироваться в новой для них реальности.
– Почти всегда остается надежда на восстановление по крайней мере некоторых из утраченных функций.
– При неполном параличе шансы восстановления выше. Анализ медицинской статистики штата Колорадо показал, что только 1 из 7 полностью парализованных после травмы пациентов смог добиться значительной степени восстановления движения. Для тех, кто сразу после травмы сохранил хотя бы слабую способность к движению конечностей, эта пропорция значительно выше: 3 из 4 таких пациентов добиваются существенных улучшений.
– При полном параличе неплохой шанс есть у того, кто сохранил чувствительность в нижней части туловища сразу после травмы. Примерно 2/3 пациентов с повреждением спинного мозга в шейном отделе после длительной реабилитации смогли нарастить достаточную силу мышц в ногах для того, чтобы ходить, при условии, что сразу после травмы они ощущали укол ноги иголкой. Что касается тех, кто ощущал только легкое прикосновение, ходить сможет примерно 1 из 8 таких пострадавших.
– Чем скорее после травмы начнут работать мышцы, тем выше шанс на прогресс, тем реальнее перспектива встать и пойти. Как правило, если мышцы становятся способны функционировать лишь через несколько недель, это с большей вероятностью будут мышцы рук, а не ног.
Сколько длится тот период, в который можно надеяться на существенное улучшение, будь то пациент с неполным или полным повреждением спинного мозга? Как долго можно жить надеждой? На этот вопрос нет однозначного ответа. Понятно, что после двух или трех лет паралича, шансы на то, что мышцы заработают без посторонней помощи, практически ничтожны.
Что же касается месяца, двух, полугода после травмы – прогноз сделать сложнее, однако есть два правила, которые помогут сориентироваться:
– Если есть постоянные улучшения, если все новые мышцы постепенно восстанавливают функцию, значит, высок шанс дальнейшего значительного прогресса.
– Чем дольше период без улучшений, тем ниже шанс на восстановление.
Что ж, эти факты внушают умеренный оптимизм даже тем, кто пострадал от обширного поражения спинного мозга. Еще больший оптимизм внушают научные разработки, которые в перспективе могут сделать паралич излечимым или, по крайней мере, создать условия для значительной адаптации пострадавших от травм спинного мозга к нормальной жизни.
Почва для оптимизма

Роб Саммерс в свои 20 лет был полон надежд: он должен был начать обучение в Университете штата Орегон, активно занимался бейсболом. Все изменилось 12 июля 2006 года: его сбила машина, после чего он оказался полностью обездвижен. И хотя у него сохранялась некоторая чувствительность в нижней части туловища, прогноз был неутешительным. Врачи сказали, что ходить Роб никогда не сможет.
В конце XX века история на этом бы и закончилась, но в наше время медицина все быстрее переходит от научной теории к практике. Робу Саммерсу и еще трем молодым людям с повреждениями спинного мозга предложили инновационную терапию – эпидуральные стимуляторы, имплантируемые в спинной мозг. Все четыре пациента, парализованные, по крайней мере, от груди и до кончиков ног, теперь в состоянии двигать ногами.
Роб Саммерс первым получил экспериментальное лечение, разработанное доктором Регги Эдгертоном из Калифорнийского университета (Лос-Анджелес) и доктором Сьюзан Харкема из Университета Луисвиля (Кентукки) при участии наших соотечественников из Института физиологии имени Павлова (Санкт-Петербург). Они опубликовали свою историю успеха в 2011 году в журнале Lancet.
В чем суть терапии?
Стимулятор подает непрерывный электрический импульс на разных частотах и разной интенсивности нижнему спинному мозгу, то есть в пояснично-крестцовую зону, и тем самым имитирует мозговые сигналы, которые инициируют движения.
Все четыре пациента приобрели способность двигать ногами сразу же после имплантации и активации стимулятора, при этом движения были произвольными. Исследователи пришли к выводу, что некоторые сигнальные пути могли остаться неповрежденными после травмы, и именно они облегчают совершение произвольных движений. Мозг воспринимает сигнал стимулятора как свой собственный, и мгновенно начинает контролировать и направлять движения мышц.
Экзоскелеты, стволовые клетки и даже носовые нейроны!
Две недели назад в журнале Scientific Reports была опубликована статья международного коллектива бразильских, американских и немецких ученых, добившихся восстановления некоторых двигательных функций у пациентов, которые в результате тяжелых травм спинного мозга были полностью парализованы в течение очень длительных сроков – от 3 до 15 лет.
Метод реабилитации включал 3 компонента: виртуальную реальность, нейроинтерфейс и роботизированный экзоскелет.
Нейроинтерфейс представляет собой электроэнцелограф, регистрирующий активность мозга и передающий данные в компьютер для анализа. Когда пациент представлял себе, что он ходит, сигналы мозга, обрабатываемые компьютерной программой, приводили к тому, что аватар на экране двигался. Когда этот этап был пройден, пациенты перешли к занятиям с экзоскелетом, также управляемым нейроинтерфейсом.
Летом 2014 года член научной команды, нейробилог Мигель Николелис, представил на чемпионате мира по футболу одного из своих парализованных подопечных в экзоскелете, и тот на глазах у изумленной публики ударил по мячу.
Научное сообщество отнеслось к этой демонстрации весьма скептически: глядя со стороны, трудно было понять, действительно ли человек в экзоскелете самостоятельно контролировал свое футуристического вида оснащение.

Эти результаты кому-то могут показаться скромными, но ведь речь идет о пациентах, у которых чувствительность и минимальные моторные функции отсутствовали годами, а, как мы знаем, даже небольшой прогресс вселяет надежду на прогресс дальнейший.
Важно заметить также, что экзоскелеты с нейроинтерфейсом и ранее использовались в экспериментах по реабилитации парализованных людей, но подобный результат был достигнут впервые благодаря тому, что начинался эксперимент с обучения действиям в виртуальной реальности.
Было бы нелогично, если паралич не попробовали бы лечить стволовыми клетками. На сегодняшний день в арсенале ученых-медиков немало экспериментов, проведенных на животных.


Ученые считают, что новая методика поможет и парализованным людям, потерявшим подвижность после травм. Впрочем, пока о клинических испытаниях терапии на людях говорить преждевременно. В ближайшее время авторы протестируют разработанную ими технологию на более крупных животных.
Чуть раньше были опубликованы результаты исследований австралийских ученых из Университета Нового Южного Уэльса. Им удалось перепрограммировать клетки костной и жировой тканей в индуцированные мультипотентные стволовые клетки, способные участвовать в регенерации любых тканей.
Команда ученых уже успешно испытала полученные стволовые клетки на мышах. Теперь ученые считают, что в 2017 году они смогут протестировать клетки на людях. С помощью новых клеток авторы планируют лечить паралич и справиться с другими заболеваниями, например, с хроническими болями в спине или последствиями травм.
В октябре 2014 года в журнале Cell Transplantation был опубликован отчет о еще одной инновационной медицинской технологии, разработанной группой польских и английских медиков во главе с нейрохирургом Павлом Табаковым.
Сорокалетний Дерек Фидика в 2010 году после удара ножом в спину оказался парализован от груди и ниже. После двух лет безуспешной терапии медики решились на экспериментальный вид лечения.
Врачи провели операцию по извлечению обонятельной луковицы пациента, затем в специальных условиях были выращены особые клетки обонятельной выстилки носа, известные своей способностью проводить нервные импульсы. После этого были сделаны микро-инъекции клеток в область повреждения спинного мозга. Наконец, в ту же область были имплантированы четыре полоски нервной ткани.
По словам врачей, пересаженные клетки, прижившись в спинном мозге, стали выполнять функцию по проведению нервных импульсов между клетками самого мозга, таким образом способствуя их регенерации и восстановлению активности.
Уже спустя три месяца после вмешательства пациент почувствовал первые изменения, ощутив мышцы собственной ноги. Спустя еще полгода он смог сделать первые шаги при поддержке специального устройства и при помощи врача.
Важное преимущество метода заключается в том, что пациенту пересаживаются клетки из его собственной обонятельной луковицы, а значит, не произойдет реакции отторжения, как это бывает с донорскими органами и клетками.
Трудно сказать, какая из описанных терапий наиболее перспективна. Важно, что их несколько, что они развиваются, и каждая дает основания для надежды на то, что в будущем паралич станет полностью излечимым заболеванием.
Читайте также:


