Камни у спинальных больных
Все оперативные вмешательства, процедуры, вызывающие боль, в современной медицине проводятся под наркозом. Вид анестезии зависит от типа, продолжительности операции, общего состояния пациента. Существует два вида анестезии: общий наркоз и спинномозговая анестезия, при которой определенный участок тела теряет чувствительность.
Что такое спинальная анестезия
Если необходимо на время операции лишить чувствительности нижнюю часть тела человека, делают наркоз спинномозговой. Суть этого метода заключается во введении анестетика в определенное место возле спинного мозга (в спину – от чего и стал этот метод так называться). Это субарахноидальное пространство, расположенное между мозговой оболочкой и спинным мозгом, наполненное спинномозговой жидкостью (ликвором).
Через ликвор проходит огромное количество крупных нервов, их передачу болевых сигналов в мозг и нужно заблокировать. Спинальная анестезия делается в области поясничного отдела, обезболивается участок ниже поясницы. Анестезиолог должен пройти иглой к позвоночнику, межпозвоночные связки, эпидуральный отдел и оболочку мозга и ввести подобранный анестетик.
Для проведения этого метода анестезии используется специальная (спинальная) очень тонкая игла, шприц и подобранный анестетик. Очень важным моментом является правильное положение пациента. На этом акцентируют внимание при эпидуральном и спинальном обезболиваниям, чтобы избежать неудачных проколов. Техника спинальной анестезии:
- наркоз в позвоночник делают в таком положении: больной находится в сидячем положении (нужно согнуть спину, прижать к груди подбородок, руки в локтях согнутые) или лежит на боку. Сидячая поза предпочтительней, спинальная зона лучше просматривается. Необходима полная неподвижность, чтобы избежать осложнений при спинальном наркозе;
- прежде чем провести наркоз в спину, врач пальпацией определяет оптимальное место для укола (зона между 5,4 и 3 позвонками);
- чтобы избежать инфицирования или заражение крови, специальными средствами обрабатывается место, где будет проводиться субдуральная анестезия, все должно быть полностью стерильно;
- проводится местное обезболивание в области введения спинальной иглы;
- игла для данной процедуры отличается длинной (около 13 см) и маленьким диаметром (около 1 мм), поэтому в некоторых случаях местное обезболивание не делают;
- игла вводится очень медленно, проходит все слои кожи, эпидуральный слой, твердую мембрану оболочки спинного мозга. При входе в субарахноидальную полость движение иглы останавливают и из нее достают мандрен (проводник, закрывающий просвет иглы). Если действие проведено правильно, из канюли иглы истекает ликвор;
- вводится анестетик, игла извлекается, место введения закрывают стерильной повязкой.
Сразу после введения препарата пациент может испытывать побочный эффект: покалывание в нижних конечностях, разливающееся тепло, длиться оно незначительное время это естественное действие анестезии. В отличие от эпидуральной (полчаса) абсолютное обезболивание при спинномозговой анестезии наступает через 10 минут. Вид препарата определяет срок действия анестезии и зависит от времени, сколько будет длиться операция.
- Как оригинально отпраздновать День рождения
- Симптомы воспаления аппендицита у женщин
- Маска против черных точек в домашних условиях
Нейроаксиальная анестезия проводится различными препаратами: местными анестетиками и адъювантами (добавками к ним). Распространенные препараты для спинномозговой анестезии:
- лидокаин. Подходит для непродолжительных операций. Используется в сочетании с фентанилом, в течение от 30 до 45 мин. обеспечивает десятый уровень блока;
- прокаин. Препарат короткого срока действия. Используется 5% раствор. Для усиления блокады комбинируют с фентанилом;
- бупивакаин. Отличие – относительные показатели действия. Срок уровня блокады до часа, возможно использование более высоких доз (от 5 мг и выше);
- наропин. Применяется при длительных операциях. Спинномозговой наркоз можно делать 0,75% раствором (3-5 часов действия) и 1% (4-6 часов);
- адъюванты: адреналин (удлиняет время блока), фентанил (усиливает анестетический эффект);
- в некоторых случаях в качестве добавки применяют морфин или клофелин.
Спинальная анестезия при кесаревом сечении
Кесарево сечение – оперативное извлечение плода с ручным отделением плаценты. Проведение обезболивания обязательно. Спинальная анестезия при кесаревом сечении – исключается риск воздействия препарата на младенца. Впервые спинальный наркоз при кесаревом сечении был применен в 1900 году Крайсом. Спинальный и эпидуральный наркоз применяется практически везде, если нет противопоказаний к применению. Укол делают разовый при нейроаксиальном наркозе (в чем главная разница с эпидуральной методикой, где вставляют катетер для ввода препарата).
Противопоказания для использования данного метода следующие: низкий уровень тромбоцитов в крови, пониженная свертываемость крови, нарушение сердечного ритма, инфекционные процессы в области введения препарата. Восстановление происходит быстро. Различие и главное преимущество по сравнению с общим наркозом – чрезвычайно низкий риск опасных осложнений для ребенка и матери, относительно низкая потеря крови.
- Салат с фунчозой
- Мовалис - инструкция по применению. Показания для препарата Мовалис в уколах или таблетках с ценой и отзывами
- Соевый соус - польза и вред для женщин и мужчин
Спинальная анестезия при родах
Самым распространенным методом обезболивания родов является Главная цель ее проведение – устранение боли в период родовой деятельности, обеспечение комфорта и безопасности роженице и ребенку. Препарат вводится в область поясницы и блокирует болевой синдром. Время рассчитывают так, чтобы эффект препарата снизился ко времени потуг, исключение составляют пороки сердца или высокая степень близорукости у роженицы. Люмбальный наркоз рекомендуется в случае:
- психологической неподготовленности женщины к родам;
- рождения первенца;
- если плод крупный;
- наступления преждевременных родов;
- стимуляции: после отхода околоплодных вод и отсутствие родовой деятельности.
Спинальная анестезия – противопоказания
Показания к спинальной анестезии разнообразны, они подразделяются на два вида: относительные и абсолютные. К относительным противопоказаниям относятся:
- экстренные случаи, когда нет времени на проведение всех подготовительных процедур с пациентом;
- неустойчивое настроение (лабильность) больного;
- аномальные нарушения строения позвоночника;
- пороки развития ребенка или смерть плода;
- повышенное внутричерепное давление;
- риск возникновения кровотечения и неопределенность времени проведения операции;
- гипоксия, заболевания центральной нервной системы.
К абсолютным противопоказаниям данного вида анестезии можно отнести:
- категорический отказ пациента;
- отсутствие условий для реанимации и плохое освещение;
- аллергия на анестетики;
- кожные инфекции: сепсис, герпес, менингит;
- гипертензия внутричерепная.
Последствия спинальной анестезии
Как и после любого наркоза СА имеет естественные последствия. Самое масштабное исследование по поводу последствий, проводилось на протяжении 5 мес. во Франции. Анализировались результаты и осложнения спинальной анестезии более 40 тыс. пациентов. Количество серьезных осложнений выглядит следующим образом:
- смерть – 0,01% (6 человек от общего количества);
- судороги – 0;
- асистолия – 0,06 (26);
- травма корешков или спинного мозга – 0,06% (24);
- синдром конского хвоста – 0,01 (5);
- радикулопатия – 0,05% (19).
К частым негативным последствиям относятся:
- брадикардия, замедление ЧСС, которое, если не принять меры, может привести к остановке сердца;
- задержка мочеиспускания (чаще страдают мужчины);
- повышение внутричерепного давления;
- спинная гематома;
- тошнота, обезвоживание;
- ППГБ – постпункционная головная боль, частое осложнение, вызывающее жалобы пациентов.












Потенциальные биохимические факторы формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой
Проведен сравнительный анализ биохимических показателей сыворотки крови и суточной мочи пациентов, у которых после позвоночно-спинномозговой травмы развилась мочекаменная болезнь (основная группа – 35 больных), с больными, у которых развития данного заболевания не наблюдалось (группа сравнения – 20 больных). Обнаружено, что у пациентов после позвоночно-спинномозговой травмы развивалась продукционная азотемия, которая приводила к нарушению выделительной функции почек (накопление мочевины, креатинина в крови и снижение их клиренса). В этих условиях происходило нарушение экскреции мочевой кислоты, магния, снижалась чувствительность почечных канальцев к действию альдостерона (у пациентов с почечнокаменной болезнью соотношение К/Na мочи было ниже). В результате у пациентов снижалась реабсорбция натрия и воды, повышалась осмоляльность мочи, что и приводило к образованию камней на фоне нарушения электролитного баланса мочи. У пациентов с позвоночно-спинномозговой травмой основным пусковым механизмом образования мочевых камней была избыточная посттравматическая азотемия. При этом рост концентрации продуктов белково-азотистого катаболизма в сыворотке крови пациентов в остром и раннем периодах позвоночно-спинномозговой травмы может являться неблагоприятным критерием, определяющим значительный риск развития у них мочекаменной болезни.
Введение. Травма позвоночника, осложненная повреждением спинного мозга, относится к важнейшим проблемам современной медицины и более чем в 80% случаев является уделом лиц молодого трудоспособного возраста, а частота осложнений и инвалидности после нее достигает 100% [1–5]. При этом нарушения функций мочевыделительной системы, по данным разных авторов, регистрируют у 77–100% больных [6, 7].
Совокупность нейродистрофических воспалительных изменений в слизистой оболочке мочевыводящих путей, их инфицирование, застой и задержка мочи, ее реакция, обменные сдвиги, возникающие при повреждении спинного мозга, рефлюкс инфицированной мочи, гиподинамия и гипокинезия создают благоприятные условия для камнеобразования в мочевом пузыре, мочеточниках и лоханках [8–10]. Установлено, что после травмы в течение 1–45 лет у 7–69% пациентов образуются камни в почках [11–15], а у 16,6–85,0% – камни в мочевом пузыре [14, 16, 17]. К особенностям мочекаменной болезни у спинальных больных относится частое отсутствие боли даже при миграции камней в мочеточнике. Мочекаменная болезнь служит своеобразным провоцирующим фактором для обострения инфекционно-воспалительных заболеваний в почках.

В литературе относительно мало работ, посвященных исследованию формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой [15, 18, 20]. Нет четкого представления об этапах и факторах патогенеза данного заболевания.
Цель работы – исследовать потенциальные биохимические факторы формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой.
Материалы и методы. Объектом исследования стала сыворотка крови и суточная моча 55 больных с позвоночно-спинномозговой травмой. Возраст их составлял от 17 до 62 лет (в среднем 35,3±1,8 года). Подавляющее большинство – мужчины: 49 (89%) человек. В остром и раннем периодах травматическойболезни (по классификации О. А. Амелиной [21]) обследованы 11 больных, в промежуточном и позднем – 44. По уровню повреждения позвоночника обследуемые были распределены на три группы. Травма позвоночника в шейном отделе констатирована у 32 больных, в грудном отделе – у 7, в грудопоясничном отделе – у 16. Нарушения функции тазовых органов были диагностированы у всех больных и проявлялись в виде задержки мочи – 17 (31%) наблюдений; недержания мочи – 19 (35%); затруднения мочеиспускания – 3 (5%); спинального автоматизма – 16 (29%). Нейрогенный мочевой пузырь был диагностирован в 100% случаев.
При задержке мочи дренирование мочевого пузыря осуществлялось уретральным катетером (n=13), эпицистостомой (n=4). При недержании мочи больные использовали уропрезерватив (n=9), подгузник (n=10). При спинальном автоматизме и затрудненном мочеиспускании отхождение мочи осуществлялось через естественные мочевыводящие пути (n=19).

Наличие мочевых камней определяли с помощью ультразвуковой установки Logic S6 (Япония), используя конвексный датчик 3–5 МГц в режиме тканевой гармоники. Выполняли ультрасонографическое исследование почек, мочеточников, мочевого пузыря.
Концентрацию мочевины, креатинина, мочевой кислоты, кальция, магния и неорганического фосфата определяли на биохимическом автоматическом анализаторе Hitachi/BM 902 (Япония) с использованием наборов реагентов фирмы Vital Diagnostic (Россия), содержание натрия, калия и хлоридов – на ионселективном блоке анализатора Hitachi/BM 902 (Япония). Указанные показатели определяли в сыворотке крови и суточной моче. Дополнительно рассчитывали клиренс метаболитов и электролитов [22].
Биохимические показатели обследованных пациентов, полученные на этапах лечения, сравнивали с аналогичными показателями 20 практически здоровых людей обоего пола в возрасте от 20 до 40 лет.
Достоверность различий показателей пациентов на сроках обследования и параметров здоровых людей оценивали с помощью W-критерия Вилкоксона для независимых выборок. Достоверность межгрупповых различий определяли с помощью непараметрического критерия Крускала–Уоллиса с последующим множественным сравнением с использованием критерия Данна.
Результаты. По результатам исследований, у 35 (64%) больных в мочевыводящих путях были определены конкременты различной величины (табл. 1). Лоцированные конкременты в основном (83% наблюдений) имели небольшие размеры (от 2 до 7 мм) и располагались с двух сторон (64% наблюдений). Данные ультрасонографии, проведенной в различные периоды позвоночно-спинномозговой травмы, позволили установить, что камнеобразованию в большей степени подвержены больные с продолжительностью заболевания более 2 лет, что может быть связано с длительным угнетением двигательной активности и нарушением функции тазовых органов (табл. 2).
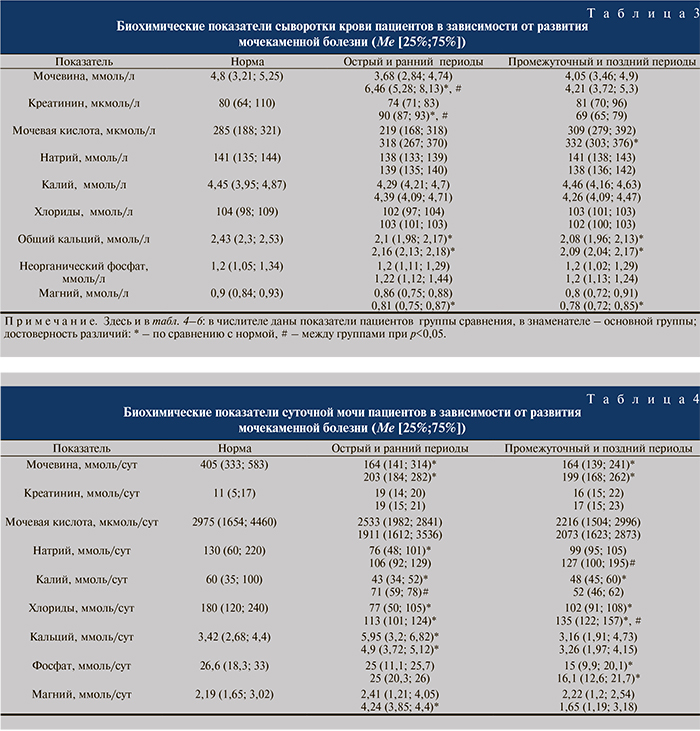
Далее нами был проведен сравнительный анализ биохимических показателей сыворотки крови и суточной мочи пациентов, у которых в посттравматическом периоде развивалась мочекаменная болезнь (основная группа – 35 больных), и больных, у которых развития данного заболевания не наблюдалось (группа сравнения – 20 больных).
Из полученных результатов обращает на себя внимание то, что у пациентов основной группы в остром и раннем периодах позвоночно-спинномозговой травмы наблюдался статистически значимый рост уровня мочевины и креатинина в крови, причем относительно как нормы, так и показателей пациентов группы сравнения (табл. 3). В остром и раннем периодах у пациентов основной группы был снижен уровень магния в сыворотке крови относительно показателей нормы.
У всех больных было отмечено снижение концентрации общего кальция в крови.
В промежуточном и позднем периодах достоверных межгрупповых различий биохимических показателей сыворотки крови не наблюдалось. Однако у пациентов основной группы отмечалось значимое повышение концентрации мочевой кислоты и снижение уровня магния относительно нормы. Установлено определенное снижение экскреторной функции почек в остром и раннем периодах у пациентов основной группы, на что указывает значительное увеличение в сыворотке крови уровня мочевины и креатинина. В свою очередь содержание мочевины в суточной моче больных в остром и раннем промежуточном и позднем периодах было достоверно ниже нормы (табл. 4). Отмечались отличия электролитного состава суточной мочи у пациентов двух групп. Так, уровень кальция в моче пациентов обеих групп был значимо выше нормы, а уровень хлорида – ниже при отсутствии межгрупповых отличий. Содержание калия в моче пациентов основной группы было в пределах нормы, однако значимо превышало таковое в группе сравнения.

Отмечен и более высокий уровень магния в моче больных основной группы в остром и раннем периодах позвоночно-спинномозговой травмы. В позднем и промежуточном периодах отмечались некоторые межгрупповые отличия. Так, в суточной моче пациентов с мочекаменной болезнью было повышено содержание натрия и хлоридов. В обеих группах зафиксировано снижение экскреции фосфатов.
Проведенное исследование показало, что у пациентов с развившейся мочекаменной болезнью в остром и раннем периодах позвоночно-спинномозговой травмы повышения уровня кальция не наблюдалось, мало того, средние показатели этого электролита, а также уровень уратов были ниже параметров группы сравнения. Единственное, что обращает на себя внимание, – это высокое содержание магния в моче пациентов основной группы в остром периоде.
Установлено, что клиренс мочевины у пациентов обеих групп был снижен как в остром и раннем, так и в промежуточной и позднем периодах позвоночно-спинномозговой травмы (табл. 5). Однако в остром и раннем периодах травмы у больных, у которых развивалась мочекаменная болезнь, клиренс мочевины снижался почти в 4 раза, тогда как у больных без развития камней – только в 1,5 (р=0,03). В остром периоде у пациентов основной группы также было зафиксировано более существенное снижение клиренса уратов и рост клиренса магния относительно как нормы, так и группы сравнения. У пациентов группы сравнения в остром и раннем периодах был снижен клиренс натрия.
Анализ скорости клубочковой фильтрации (СКФ) позволил обнаружить значимое увеличение данного показателя у больных с позвоночно-спинномозговой травмой обеих групп при отсутствии межгрупповых отличий (табл. 6). Интересными с позиции патогенеза мочекаменной болезни при позвоночно-спинномозговой травме представляются другие результаты исследования. Так, у больных основной группы отмечались более существенное снижение скорости экскреции кальция на всех этапах позвоночно-спинномозговой травмы, а также более высокие показатели осмоляльности мочи относительно показателей пациентов группы сравнения. Оценка влияния минералкортикоидов на экскрецию электролитов выявила, что у пациентов, у которых развитие мочекаменной болезни не происходило, наблюдалось более высокое, хотя и недостоверное, значение К/Na-коэффициента мочи, т.е. реакция надпочечников у них была более выражена и направлена на сохранение натрия и воды в организме.
Обсуждение. Данные литературы, посвященной исследованию состояния мочевыделительной системы у больных с позвоночно-спинномозговой травмой, свидетельствуют о том, что риск образования мочевых камней в почках и мочевом пузыре у данной категории больных выше, чем в обычной популяции людей [13]. При этом анализ, проведенный S. Ramsey и соавт. [15], показал, что в большинстве научных публикаций биохимические исследования не выявляют существенных различий показателей крови и мочи у больных в зависимости от наличия мочекаменной болезни, хотя отмечаются достоверные изменения относительно параметров здоровых людей.

M. Nagashima и соавт. [17] также пришли к выводу, что нет никакой разницы между двумя группами пациентов в отношении рН мочи и видов бактерий, обнаруженных в ней. По данным R. Burr и соавт. [18], особенностью формирования мочекаменной болезни у больных с позвоночно-спинномозговой травмой является уменьшение выделения цитрата с мочой. Роль последнего связана с возможностью подавлять образование, рост и агрегацию кристаллов оксалата кальция и фосфата кальция [23].
Следует заметить, что у пациентов с позвоночно-спинномозговой травмой часто встречаются и инфекционные камни. Бактериальные патогены, такие как Proteus, Pseudomonas, Klebsiella, некоторые стафилококки, микоплазмы, сильно ощелачивают мочу, что способствует суперсатурации и кристаллизации магния и фосфатов аммония. Частота образования струвитных камней при таких нарушениях достигает 70% [19, 20, 24, 25]. При этом соотношение струвитных и карбонатапатитных камней, как правило, растет с увеличением времени, прошедшим после травмы [11, 18].
Полученные нами данные позволяют сформулировать определенные положения о патогенезе мочекаменной болезни после позвоночно-спинномозговой травмы. В частности, патофизиологическая картина складывается из двух основных параллельно протекающих событий: 1) в остром периоде позвоночно-спинномозговой травмы происходит снижение перфузии почек кровью на фоне посттравматического шока; 2) в посттравматическом периоде развивается продукционная азотемия различной степени выраженности в зависимости от тяжести травмы. Последнее обстоятельство и является ключевым в развитии мочекаменной болезни: увеличение нагрузки на почки в данном состоянии приводит к развитию почечной азотемии в результате нарушения выделительной функции почек (накопление мочевины, креатинина в крови и снижение их клиренса). В этих условиях происходит нарушение экскреции мочевой кислоты, магния, снижается чувствительность почечных канальцев к действию альдостерона (у пациентов с мочекаменной болезнью соотношение К/Na мочи было ниже). В результате последнего у пациентов снижается реабсорбция натрия и воды, повышается осмоляльность мочи. Рост осмоляльности мочи происходит на фоне нарушения электролитного баланса мочи, что и приводило к образованию камней. Причем основным анионом в данном случае, по-видимому, являлись ураты, в пользу чего говорило значительное снижение их клиренса в остром и раннем периодах позвоночно-спинномозговой травмы у пациентов с развившейся мочекаменной болезнью, а катионом – ионы магния.
Представленные данные позволяют также заключить, что накопление в сыворотке крови пациентов с позвоночно-спинномозговой травмой в остром и раннем периодах продуктов азотистого обмена может являться определенным критерием риска развития мочекаменной болезни. Так, у всех обследованных нами пациентов, у которых развития мочекаменной болезни не отмечалось, концентрация мочевины в остром и раннем периодах позвоночно-спинномозговой травмы находилась в пределах нормы (2–8 ммоль/л).
В свою очередь у половины пациентов с развившейся в ходе лечения мочекаменной болезни отмечалось повышение концентрации мочевины в сыворотке крови в пределах 8–10,2 ммоль/л.
Заключение. Полученные нами результаты указывают на то, что у больных с позвоночно-спинномозговой травмой основным пусковым механизмом образования мочевых камней стала избыточная посттравматическая азотемия. При этом рост концентрации продуктов белково-азотистого катаболизма (мочевина, мочевая кислота, креатинин и др.) в сыворотке крови пациентов в остром и раннем периодах позвоночно-спинномозговой травмы может быть неблагоприятным критерием, определяющим значительный риск развития у них мочекаменной болезни.
Спинальный мочевой пузырь – это нарушение функции мочевого пузыря, которое развивается вследствие нарушения его иннервации волокнами спинного мозга. Спинальный мочевой пузырь - частный случай нейрогенного мочевого пузыря.
Причины спинального мочевого пузыря
Основной причиной спинального мочевого пузыря считается травма позвоночника с разрывом или повреждением спинного мозга. В результате этого нарушается иннервация мочевого пузыря и развивается типичная клиническая картина. Кроме травматического повреждения, причиной спинального мочевого пузыря могут служить и другие факторы. К примеру, злокачественные или доброкачественные новообразования, которые развиваются в спинномозговом канале, могут пережимать спинной мозг, из-за чего также развивается картина спинального мочевого пузыря.
Разрыв спинного мозга
В литературе известны случаи, когда симптомы спинального мочевого пузыря развивались после неудачно проведенного оперативного вмешательства на позвоночнике. Подобное заболевание называется ятрогенный спинальный мочевой пузырь, что обозначает развитие патологии из-за неудачного вмешательства врача.
Кроме этого, паралитическое действие на нервные корешки поясничной области могут оказывать некоторые сильнодействующие ядовитые вещества. Поэтому, при типичных симптомах спинального мочевого пузыря необходимо учитывать данные анамнеза заболевания – не принимал ли больной незадолго до развития симптоматики подозрительных веществ.
Симптомы спинального мочевого пузыря
Клиническое проявление спинального мочевого пузыря всего одно – это задержка мочи. Правда, она несколько отличается от задержки мочи, к примеру, при аденоме или раке предстательной железы. Основным дифференциальным признаком спинального мочевого пузыря является то, что ему сопутствует нарушение функции прочих тазовых органов и нижних конечностей.
Еще одной особенностью является то, что даже при переполненном мочевом пузыре пациент не ощущает боли. Это может закончиться разрывом органа и попаданием мочи в брюшную полость с последующим развитием перитонита, исход которого может быть разным, вплоть до летального.
Конечно, при травматическом повреждении спинного мозга, когда возникает паралич нижних конечностей и нарушение функции кишечника, больной немедленно госпитализируется. Иная ситуация может наблюдаться при опухоли спинномозговых оболочек, когда паралич мочевого пузыря является единственным симптомом. При этом, пациенты довольно часто ищут причину задержки мочи в патологии простаты и самостоятельно лечатся народными средствами. Это приводит к упомянутым осложнениям. Поэтому, при задержке мочеиспускания, особенно безболезненной, необходимо немедленно обращаться к урологу для того, чтобы он нашел причину данной проблемы.
Диагностика спинального мочевого пузыря
На самом начальном этапе необходимо определиться с тем, поступает ли моча в мочевой пузырь или она даже не фильтруется почками. Для данной цели производится постановка уретрального катетера . Если по трубке выходит моча, значит проблема не в почках, а именно в сфинктерном аппарате мочевого пузыря, который иннервируется именно со спинного мозга. При этом, если задержка мочи была больше суток и мочевой пузырь растянут больше обычного, могла нарушиться целостность сосудов его стенки и в моче могла появиться примесь крови. К такой ситуации необходимо быть готовым, чтобы не перепутать спинальный мочевой пузырь с гломерулонефритом, при котором также может отмечаться кровавое мочеиспускание.
Для окончательного подтверждения нормального функционального состояния почек можно провести экскреторную урографию . Для этого в вену вводится контрастное вещество, после чего область малого таза исследуется под рентгеновскими лучами. Если почки функционируют нормально, то в мочевом пузыре регистрируется контрастное вещество.
Для выяснения точной причины заболевания больным рекомендуется проводить МРТ и КТ позвоночника . Данные исследования дают возможность обнаружить травматическое повреждение или новообразование, которое и стало причиной патологии. Эти исследования крайне необходимы для определения тактики лечения, в частности, для выбора места оперативного доступа.
Еще одним из методов выявления патологии спинного мозга можно считать спинномозговую пункцию . Если у пациента есть травматическое повреждение, то в ликворе будет обнаруживаться кровяная примесь, при онкопатологии спинномозговая жидкость содержит большое количество белка.
Лечение спинального мочевого пузыря
Лечение патологии зависит от ее причины. Если у пациента есть доказанный онкопроцесс, то применяется оперативное вмешательство, целью которого является удаление новообразования. При травматическом повреждении, в случае возникновения субарахноидальной гематомы также может применяться операция для ликвидации сгустка крови.
Переломы позвоночника, сопровождающиеся разрывами спинного мозга, должны лечиться в нейрохирургическом стационаре. После того, как проведена операция по сшиванию спинного мозга, человек нуждается в иммобилизации специальными позвоночными шинами. В таком положении больные могут находиться до года, пока не осуществиться полная консолидация перелома. Стоит отметить, что далеко не всегда подобная тактика дает положительные результаты, но на сегодняшний день она является единственной эффективной методикой лечения подобных больных.
Параллельно с лечение основной причины заболевания, производятся процедуры по эвакуации мочи из мочевого пузыря. Существует разные методики, но все оны должны быть направлены на профилактику вторичного инфицирования. Наиболее опасной техникой является постановка обычного уретрального катетера, которая практически всегда заканчивается воспалением слизистой оболочки мочевого пузыря. Если нет возможности наладить другую систему эвакуации мочи, уретральный катетер необходимо ставить под местным и общим прикрытием антибактериальной терапией.
Наверное, идеальной методикой промывания мочевого пузыря и эвакуации мочи можно считать приточно-отточную систему Монро. Аппарат состоит из обычного уретрального катетера, к которому подсоединяются сразу две трубки. К одной подключается система с антисептическим раствором, расположенная над кроватью пациента, а вторая опускается в сосуд, что находится под кроватью больного. Таким образом, под силой земного притяжения, антисептик попадает в мочевой пузырь, где обезвреживает бактерии и вместе с мочой вытекает в банку под кроватью.
Особенности питания и образ жизни со спинальным мочевым пузырем
Как бы не печально это звучало, но такие пациенты, в основном, ведут сидячий образ жизни. К этому их вынуждает приспособление к специальному инвалидному инвентарю, который может улучшить качество жизни.
Что касается диеты, то она отталкивается от плохой перистальтики кишечника. Больным, чтобы избежать запоров, необходимо принимать жидкую и перетертую еду, которая легко усваивается, а остатки также легко выходят из кишечника.
Реабилитация после болезни
Больные со спинальным мочевым пузырем, которые в большинстве своих случаев являются инвалидами, прежде всего, нуждаются в психологической поддержке. Для этого в нашей стране существуют специальные центры для реабилитации инвалидов. Там с ними проводятся как физические, так и психологические упражнения, которые дают возможность тренировать рабочие участки тела и повышать тонус нервной системы. На сегодняшний день для инвалидов созданы хорошие условия. Они даже имеют возможность выступать на спортивных соревнованиях, где соперничают с такими же людьми.
Главной задачей медицинского персонала, который обслуживает пациента в первые недели заболевания, является сильная физическая и моральная поддержка, для того, чтобы у него не возникало глупых и ненужных идей.
Лечения спинального мочевого пузыря народными средствами
Как можно было уже догадаться, что лечение народными средствами в подобной ситуации является не то, что неэффективным, а просто нецелесообразным. Пациенты с подобными проблемами, для того, чтобы получить хотя бы малейший шанс на выздоровление, должны с первых дней получить серьезную и квалифицированную медицинскую помощь. Стоит отметить, что с каждым годом уровень выздоровления спинальных больных заметно повышается.
Осложнения спинального мочевого пузыря
Первым осложнением, которое может ждать больного, является разрыв мочевого пузыря с образованием перитонита и смертью. Чтобы подобного не произошло, необходимо немедленно подключать к лечению уролога, для того, чтобы он вовремя и правильно эвакуировал мочу из мочевого пузыря.
Поскольку больные со спинальным мочевым пузырем постоянно живут с уретральным катетером, его необходимо периодически менять. Катетер, которые находится в мочеиспускательном канале более, чем трое суток, способен вызывать пролежень и гангренозный уретрит. В перспективе, мужчине это может грозить оперативным вмешательством - ампутацией полового члена.
Не стоит забывать о пролежнях, которые могут образовываться на коже тех участков, которые плотно прилегают к костным выступам на теле человека.
Система эвакуации мочи и промывания мочевого пузыря должна постоянно чиститься и меняться. Бывали случаи, когда трубка катетера банально забивалась, что приводило к скоплению мочи в мочевом пузыре и заражении им крови.
Профилактика спинального мочевого пузыря
Понятно, что профилактировать само заболевание сложно. Попытаться сделать это должны люди, которые занимаются травматическими видами спорта или работают в опасных условиях. На сегодняшний день существует много специальных корсетов и ремней, которые защищают позвоночник от переломов и ушибов при падении и ударах.
Также о своей безопасности необходимо побеспокоиться за рулем, поскольку наибольшее количество спинальных травм происходит именно там. В этой ситуации единственным средством профилактики может послужить автомобиль с подушками безопасности в салоне.
Большее внимание необходимо уделить профилактике осложнений спинального мочевого пузыря. Так, пролежни можно предупредить, используя специальные матрасы или банальные мешочки с песком, которые подкладывают под костные выступы на теле человека. Кроме этого, необходимо следить за тем, чтобы на постельном белье не было складок, а тело пациента постоянно переворачивалось и не находилось в одном положении, что способствует застою крови и образованию пролежней.
Читайте также:


