Эмболизация опухолей голова шея
Батрашов В.А., Ветшев П.С., Сергеев О.Г., Юдаев С.С.
Параганглиомы головы и шеи или опухоли гломуса - это нейроэндокринные опухоли, источником которых являются параганглионарные клетки, мигрировавшие в период внутриутробного развития из нервного гребня и находящиеся в близких взаимоотношениях с ганглионарными клетками вегетативной нервной системы.
В области головы и шеи параганглиомы, как правило, исходят из каротидного тельца, тимпанического сплетения, яремной луковицы, вагальных и симпатических ганглиев. Наиболее частым местом локализации параганглиом на голове и шее является бифуркация общей сонной артерии.
Каротидные параганглиомы обычно представляют собой опухолевидное образование в области шеи. Обычно параганглиомы характеризуются медленным ростом и бессимптомным течением, что является одной из причин их поздней диагностики (чаще после 50 лет).
Увеличиваясь в размерах, опухоль может распространяться вдоль сонных артерий с вовлечением в патологический процесс расположенных рядом нервов, включая блуждающий, подъязычный нервы, симпатический ствол. Именно с этим связана клиническая симптоматика заболевания: головные боли, боли в области шеи, головокружение, осиплость голоса, першение в горле, дисфагия, синдром Горнера-Клода Бернара, нарушение слуха.
Клиническое наблюдение
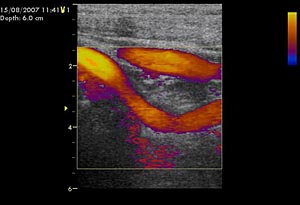
Рис. 1. Дуплексное сканирование сонных артерий.
Пациент Т., 36 лет, поступил в отделение сосудистой хирургии НМХЦ им. Н.И. Пирогова в июне 2007 г. с жалобами на наличие опухолевидного образования в левой половине шеи, дисфагию. Данное образование отмечалось у пациента в течение нескольких лет, при этом за последние несколько месяцев отмечено увеличение опухоли в размерах.
При физикальном обследовании определялось опухолевидное образование размером 6х4 см, с гладкой поверхностью, плотно-эластической консистенции, безболезненное, малоподвижное. По данным ультразвукового дуплексного сканирования внечерепных отделов брахиоцефальных артерий в левой подчелюстной области было выявлено округлое образование, в капсуле, размерами 62х41х37 мм, со слабой васкуляризацией по стенкам и в центре опухоли, не связанное с сонными артериями.
Образование принадлежит к латеральной стенке левой каротидной бифуркации и передне-латеральной стенке проксимальной порции левой внутренней сонной артерии. Также отмечалась С-образная извитость левой внутренней сонной артерии, вызванная механическим сдавлением объёмным образованием (рис.1).
При компьютерной томографии было подтверждено наличие объемного образования с участками повышенной (54 ед.) и пониженной (30 ед.) плотности (рис. 2). Образование раздвигает окружающие ткани и оттесняет левую подчелюстную слюнную железу кпереди.
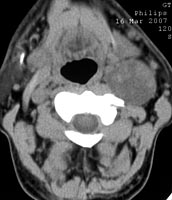
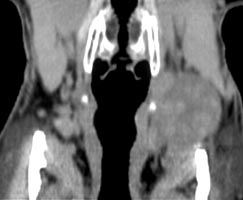
Рис. 2. Компьютерная томография мягких тканей шеи
С целью уточнения особенностей кровоснабжения опухоли, а также решения вопроса о возможной эмболизации питающих опухоль сосудов была выполнена ангиография дуги аорты и брахиоцефальных артерий. При ангиографическом исследовании было выявлено слабо васкуляризованное образование, вызывающее перегиб левой внутренней сонной артерии в первом сегменте (рис.3).
Учитывая отсутствие крупных питающих опухоль сосудов, селективная эмболизация не выполнялась.
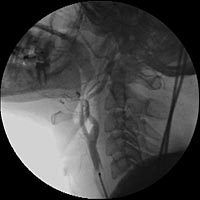
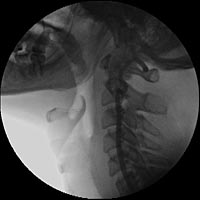
Рис. 3. Ангиография дуги аорты и брахиоцефальных артерий
Учитывая, что по данным литературы консервативное лечение параганглиом шеи неэффективно, пациенту была выполнена радикальная операция: удаление опухоли средней трети шеи слева.
Техника операции
В условиях общей анестезии был выполнен разрез по переднему краю грудинно-ключично-сосцевидной мышцы. Выделены и взяты на держалки общая, внутренняя и наружная сонные артерии.
Обнажены подъязычный и блуждающий нервы. При ревизии было установлено, что опухоль исходит из симпатического ствола и тесно связана с последним (рис. 4 А, Б).
После этого образование было выделено и удалено в пределах здоровых тканей с резекцией симпатического ствола. Опухоль имела хорошо выраженную капсулу и макроскопически напоминала невриному (рис. 5.). Следует отметить, что в до- и интраоперационном периоде проводилось определение толерантности больного к пережатию сонной артерии: транскраниальная допплерография, измерение ретроградного давления в общей сонной артерии.
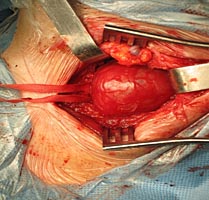
Рис.4. А. Интраоперационная картина.
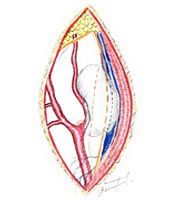
Б. Схема расположения опухоли.
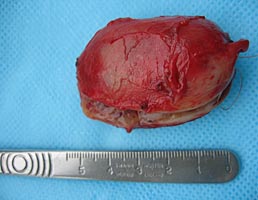
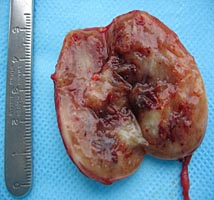
Рис. 5. Макропрепарат параганглиомы
При гистологическом исследовании опухоль была представлена вытянутыми веретеновидными клетками с обилием разнокалиберных сосудов.
При этом обращали на себя внимание гиперхромия и полиморфизм опухолевых клеток (рис. 6 А, Б). Таким образом, был подтвержден диагноз атипичной параганглиомы.
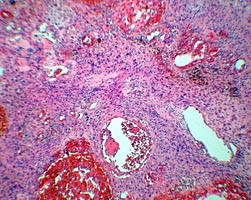
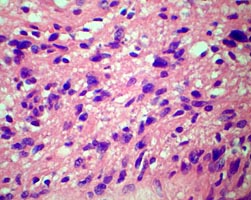
Рис. 6. А и Б. Микропрепарат параганглиомы
Послеоперационный период протекал без осложнений, и пациент был выписан на седьмые сутки после операции. К настоящему времени срок наблюдения за пациентом составляет более двух лет.
Рецидивирования симптоматики и опухолевого роста у пациента не отмечено.
Мягкотканные опухоли головы и шеи представляют собой разнородную группу заболеваний, в которую входят как сосудистые опухоли с доброкачественным течением, так и мягкотканные саркомы, характеризующиеся местно деструктирующим ростом и возможностью появления отдаленных метастазов. В данной статье будет описан целый ряд таких опухолей, акцент будет сделан на их течение, диагностику и лечение.
а) Параганглиома. Параганглиомы представляют собой сосудистые опухоли, происходящие из вненадпочечниковых параганглиев нервного гребня. Чаще всего они возникают на голове и шее. Эти опухоли тесно связаны либо с кровеносными сосудами (сонной артерией, луковицей яремной вены), либо нервами (блуждающим нервом, барабанным сплетением).
Обычно параганглиомы растут медленно, характер их роста можно назвать двухфазным, потому что опухоли малого и крупного размера растут значительно быстрее, чем промежуточные по размеру.
Параганглиомы могут возникать у пациентов с семейным эндокринным аденоматозом, как типа IIА (феохромоцитома, медуллярный рак щитовидной железы, гиперплазия паращитовидных желез), так и типа IIВ (включая и невриномы слизистых оболочек). Иногда заболевание носит семейный характер. Достаточно часто встречаются многоочаговые опухоли, и среди семейных, и среди спорадических случаев заболевания. Семейные или наследственные параганглиомы составляют около 5-10% от всех случаев параганглиом головы и шеи, по некоторым данным, их частота может достигать 25-50%.
В большинстве случаев наследственных параганглиом (90%) в процесс вовлекается сонная артерия. При семейной форме заболевания вероятность нахождения многоочаговых параганглиом достигает 78-87%. Наиболее частым вариантом многоочаговой опухоли является двусторонняя хемодектома, которая встречается примерно у 20% пациентов с опухолями каротидного гломуса.
Злокачественные параганглиомы встречаются редко. Такой диагноз может быть выставлен только при обнаружении метастазов, поскольку данные гистологического исследования первичной опухоли обычно не позволяют подтвердить злокачественность. Частота встречаемости злокачественных параганглиом зависит от их локализации, данные разных исследований сильно варьируют. При опухолях каротидного гломуса метастазы чаще всего встречаются в костях, легких и печени. Наследственные параганглиомы по сравнению со спорадическими реже бывают злокачественными.
При яремно-барабанных параганглиомах метастазы чаще всего встречаются, в порядке убывания, в легких, лимфоузлах, печени, позвоночнике, ребрах и селезенке. По данным литературы, частота малигнизации вагальных параганглиом может достигать 19%, но более вероятной считается цифра около 10%. Первичные опухоли глазницы и гортани наиболее часто оказываются злокачественными (20-25%) среди всех параганглиом головы и шеи.
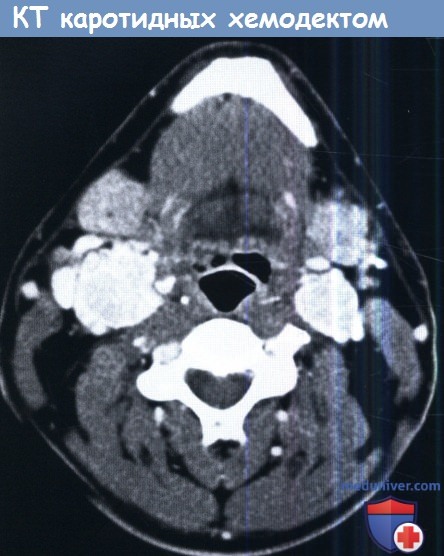
КТ с контрастом, аксиальный срез.
Двусторонние каротидные хемодектомы, интенсивно накапливающие контраст.
б) Опухоль каротидного гломуса (хемодектома). В процессе роста опухоль отодвигает наружную и внутреннюю сонные артерии друг от друга, постепенно проникая в адвентициальную оболочку. В типичных случаях, внутренняя сонная артерия смещается кзади и латерально. Далее опухоль по внутренней сонной артерии продолжает рост кверху, в сторону основания черепа, где она может вызвать деструкцию костных тканей или поражать близлежащие черепные нервы (чаще всего блуждающий и подъязычный). Иногда в процесс вовлекается симпатический ствол. В 20% случаев опухоль растет в медиальном направлении, проникая в окологлоточное пространство.
в) Яремная и барабанная параганглиомы. Барабанные параганглиомы развиваются из параганглиев нерва Якобсона и нерва Арнольда. Они могут полностью заполнять полость среднего уха, распространяться кзади, к сосцевидные ячейки височной кости и луковице яремной вены. Обычно рост опухоли происходит в нескольких направлениях — вдоль естественных слабых мест черепа, постепенно новообразование распространяется в различные отделы височной кости и отверстия основания черепа. При продолжении роста в височную кость опухоль поражает заднюю черепную ямку.
Внутричерепное распространение происходит либо через прямое прорастание кзади через пирамиду височной кости, либо через внутренний слуховой проход, либо под костным лабиринтом. Часто опухоль распространяется в область внутренней яремной вены и сигмовидного синуса, возможно поражение нижнего каменистого синуса. Опухоль может прорастать во все отделы среднего уха, верхушку пирамиды, клетки сосцевидного отростка и ретрофациальные клетки. Яремные параганглиомы могут спускаться на шею, прорастая в подвисочную ямку и позадишиловидный отдел окологлоточного пространства.
Данные опухоли имеют три типичных схемы роста. Поскольку большая их часть происходит из узлового ганглия, вагальные параганглиомы склонны расти книзу, в позадишиловидный отдел окологлоточного пространства. При распространении кверху, в сторону основания черепа и яремного отверстия, в процесс рано вовлекается яремная вена и черепные нервы (IX, XI, XII). Обычно опухоль смещает внутреннюю сонную артерию кпереди. Опухоли верхнего ганглия часто имеют форму гантели: одна их часть распространяется в заднюю черепную ямку, а другая спускается в окологлоточное пространство.
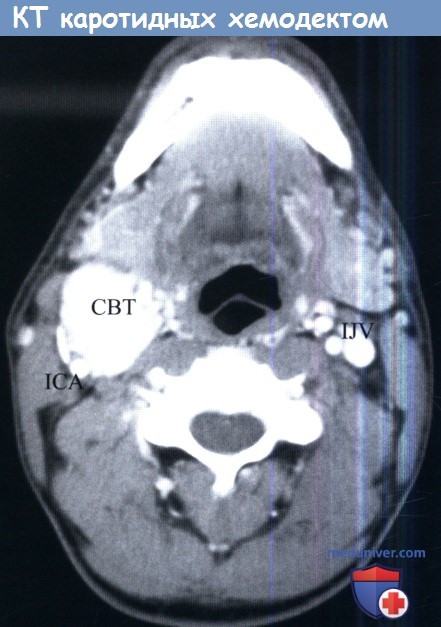
КТ с контрастом, аксиальный срез. Внутренняя сонная артерия каротидной хемодектомой смещена кзади и в латеральную сторону.
СВТ, carotid body tumor—КХ, каротидная хемодектома;
ICA, internal carotid artery — ВСА, внутренняя сонная артерия;
IJV, internal jugular vein — ВЯВ, внутренняя яремная вена.
Диагностика мягкотканных опухолей головы и шеи
а) Хемодектома. Медианный возраст пациентов составляет 45-54 года, опухоль может встречаться у лиц от 12 до 78 лет. Женщины страдают чаще мужчин (2:1). Наиболее частым поводом для обращения является появление припухлости на шее. Обычно образование на уровне или чуть выше бифуркации общей сонной артерии, залегает глубже грудинно-ключично-сосцевидной мышцы. При пальпации образование смещается в боковом направлении, но не в вертикальном, поскольку оно фиксировано к сонной артерии. Иногда может пульсировать. Шумы удается определить в 10-16% случаев. На боль жалуется около 25% пациентов.
Возможно распространение опухоли в медиальном направлении в окологлоточное пространство, в таком случае будет отмечаться смещение небных миндалин и выбухание слизистой оболочки боковой стенки глотки. В момент обращения к врачу нейропатия черепных нервов присутствует в 10-30% случаев.
При распространении в среднее ухо происходит поражение слуховых косточек с развитием кондуктивной тугоухости. Дальнейший рост с захватом лабиринта приводит к появлению головокружений, нейросенсорной тугоухости и, при присоединении воспаления, болевого синдрома.
Яремные параганглиомы обычно появляются на пятом-шестом десятке жизни. Женщины страдают чаще мужчин, соотношение варьирует от 4:1 до 6:1. При распространении опухоли в среднее ухо возникают симптомы, аналогичные барабанной параганглиоме (кондуктивная или нейросенсорная тугоухость), в зависимости от степени инвазии опухоли. Чаще всего пациентов беспокоит снижение слуха (55-77%) и шум в ушах (56-72%). Также часто встречаются симптомы, связанные с поражением черепных нервов (VII—XII).
Опухоли основания черепа, не прорастающие в среднее ухо, могут сопровождаться слабостью мышц языка, охриплостью, дисфагией, опущением плеча, либо другими симптомами поражения черепных нервов. Иногда встречается синдром яремного отверстия (паралич IX, X и XI черепных нервов или синдром Вернета), паралич IX-XII нервов (синдром Сикара-Колле) встречается у 10% пациентов с яремными параганглиомами.
в) Вагальные параганглиомы. Вагальные параганглиомы чаще всего проявляются в виде бессимптомного образования на шее, обычно они расположены более краниально, чем каротидные хемодектомы. Растут медленно, женщины страдают чаще мужчин в соотношении от 2:1 до 3:1. По мере роста опухоли она начинает распространяться на нижние черепные нервы и близлежащие отделы симпатического ствола. К симптомам также относят одностороннее нарушение подвижности голосовых складок, охриплость, дисфагию, заброс пищи и жидкости в нос, атрофию одной половины языка, слабость плечевой мускулатуры, синдром Горнера. Снижение слуха и шум в ушах являются признаками прорастания в височную кость.
Для постановки диагноза обычно используют компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ). При помощи ПЭТ с индием In111 пентреотидом (Octreo Scan; Mallinckrodt Medical, Petten, The Netherlands) или фтором F18 дигидроксифенилаланином (допа) можно уточнить размер первичной опухоли, оценить наличие множественных опухолей или метастазов. Ангиография помогает определить источники кровоснабжения и визуализировать вовлечение (или поражение) крупных сосудов. При планировании хирургического лечения также проводится эмболизация.
Лечение мягкотканных опухолей головы и шеи
а) Хирургическое лечение. Традиционно предпочтительным методом лечения параганглиом является их хирургическое удаление, особенно в свете появления новых хирургических доступов к основанию черепа, разработки безопасных протоколов эмболизации, развития эндоваскулярных вмешательств. Тем не менее, при раннем поражении черепных нервов и основания черепа высок риск развития послеоперационных неврологических осложнений, которые потребуют длительного периода реабилитации. Поэтому роль хирургической резекции в качестве основного метода лечения этих медленнорастущих опухолей должны быть пересмотрена.
Было показано, что некоторые параганглиомы, особенно небольшого размера, практически не прогрессируют. У данных пациентов может использоваться выжидательная тактика с периодическим контролем роста опухоли. Относительными противопоказаниями к оперативному лечению являются распространение на основание черепа или в полость черепа, пожилой возраст, наличие тяжелых сопутствующих заболеваний, двусторонние или множественные параганглиомы. В этих случаях оперативное лечение имеет слишком высокую частоту послеоперационных осложнений, может стать причиной тяжелой дисфункции черепных нервов.
Перед проведением операции необходимо провести эмболизацию сосудов опухоли. При выполнении всех условий, сочетание эндоваскулярной эмболизации с хирургической резекцией позволяет добиться успеха. Оперативное вмешательство должно быть проведено не позднее двух дней с момента эмболизации, пока не началось восстановление кровотока по коллатеральным сосудам. Если предполагается, что отек тканей вокруг опухоли помешает удалению, перед операцией проводится краткий курс глюкокортикоидов.
б) Лучевая терапия. Лучевая терапия традиционно проводилась пожилым пациентам, пациентам с тяжелыми сопутствующими заболеваниями, а также при неоперабельных параганглиомах. Тем не менее, в последние годы были получены сведения о том, что лучевая терапия является высокоэффективным методом лечения, который может быть рассмотрен в качестве альтернативы операции, связанной с высоким риском осложнений. Чаще всего лучевая терапия использовалась для лечения яремных параганглиом височной кости, реже — каротидных и вагальных параганглиом.
Лучевая терапия является предпочтительным методом лечения распространенных опухолей. Стереотактическая радиохирургия делает возможным однократное высокоточное воздействие на опухоль лучевым излучением с малым полем действия, что позволяет максимально щадить окружающие ткани.
Похожие темы научных работ по клинической медицине , автор научной работы — Хайрутдинов Е. Р., Цуркан В. А., Араблинский А. В.
МАТЕРИАЛЫ V РОССИЙСКОГО СЪЕЗДА ИНТЕРВЕНЦИОННЫХ КАРДИОАНГИОЛОГОВ
эффективная доза в основной группе статистически значимо не отличались от таковых в группе сравнения. Осложнений не было.
Выводы. Нарушения ритма сердца, требующие интервенционной коррекции, у детей в 4% случаев ассоциированы с такими ВПС, как МД, ОАП или коронаро-легочная фистула. Наиболее часто сочетаются синдром Вольфа-Паркинсона-Уайта с МД (35 (54%) больных). Одномоментное интервенционное лечение аритмий и коррекция ВПС - эффективная и безопасная процедура. Интервенционное вмешательство, направленное на устранение нарушений ритма сердца и коррекцию сопутствующих ВПС во время одной процедуры, является рациональной стратегией лечения в педиатрической практике.
Выбор тактики эндоваскулярной реваскуляризации миокарда при многососудистом поражении коронарных артерий
Хайрутдинов Е.Р12, Шугушев З.Х.1, Максимкин Д.А.', Араблинский А.В.23
Цель исследования: сравнить результаты различных тактик эндоваскулярной реваскуляризации миокарда у пациентов с ИБС при многососудистом поражении коронарных артерий.
Материал и методы. С 2007 г в исследование было включено 175 больных, которые после проведения рандомизации были разделены на две группы: полной (83 пациента) и неполной (92 больных) реваскуляризации миокарда. Все пациенты в соответствии с разработанным алгоритмом были разделены на три группы: полная (1-я группа, n = 63), функционально адекватная (2-я группа, n = 86) и неполная (3-я группа, n = 22) реваскуляризация миокарда. Еще 4 больным была выполнена операция КШ, и в дальнейшем из исследования они были исключены. Исследуемые группы были сопоставимы по основным клиническим характеристикам. В предоперационном периоде пациентам выполнялись комплексное лабораторное и инструментальное обследования, включавшие обязательное проведение нагрузочной пробы. Эндоваскулярные вмешательства проводились на фоне двойной антиагрегантной терапии. Всего у 171 больного было выполнено 205 эндоваскуляр-ных вмешательств на коронарных артериях.
Результаты. Выживаемость пациентов на госпитальном этапе во всех группах составила 100%. Частота развития инфарктов миокарда (1-я группа- 1 (1,6%), 2-я группа- 1 (1,2%) и 3-я группа - 1 (4,55%) соответственно (р > 0,05), повторных процедур реваскуляризации миокарда (0 (0%), 1 (1,2%) и 1 (4,55%) соответственно (р > 0,05)) и основных сердечнососудистых осложнений (1 (1,6%), 1 (1,2%) и 1 (4,55%) соответственно (р > 0,05)) достоверно не различалась. Регресс клинической картины стенокардии на два функциональных класса и более наблюдался у 100% больных из 1-й и 2-й группы и 72,7% пациентов из 3-й группы (р 0,05)). В то же время операции КШ достоверно чаще выполнялись в 3-й группе (0 (0%), 0 (0%) и 1 (4,55%) соответственно (р = 0,033)). Совокупный показатель основных сердечно-сосудистых осложнений составил в 1-й группе 7 (11,11%), во 2-й группе - 12 (13,95%) и в 3-й группе - 6 (27,27%) (р > 0,05).
Заключение. Тактика полной и функционально адекватной реваскуляризации миокарда при многососудистом поражении коронарного русла у пациентов с ИБС имеет сопоставимые
непосредственные и отдаленные результаты вмешательства. Выполнение неполной реваскуляризации миокарда сопряжено со снижением непосредственного клинического успеха эндоваскулярного вмешательства, а также характеризуется повышением частоты развития инфарктов миокарда и выполнения операций КШ в отдаленном периоде наблюдения.
Непосредственные результаты эндоваскулярной эмболизации кровотечений у пациентов с опухолями головы и шеи
Хайрутдинов Е.Р., Цуркан В.А., Араблинский А.В.
Отделение рентгенохирургических методов диагностики и лечения ГБУЗ “ГКБ им. С.П. Боткина ДЗ г. Москвы"
Кафедра терапии и подростковой медицины ГБОУ ДПО “РМАПО"
Цель исследования: оценить эффективность эндоваскулярной эмболизации в лечении кровотечений у пациентов с опухолями головы и шеи.
Материал и методы. В период с января 2010 по декабрь 2013 г. 25 больным с опухолями головы и шеи была выполнена эндоваскулярная эмболизация в связи с кровотечением. Этиологическими причинами кровотечения у 3 (12%) больных была карцинома языка, у 2 (8%) - плоскоклеточная карцинома миндалины, у 3 (12%) - карцинома мягкого неба, у 5 (20%) -кацинома гортани, у 7 (28%) - рак щитовидной железы и у 5 (20%) - карцинома глотки. Возраст больных колебался от 32 до 77 лет, средний возраст составил 56,3 года. Большинство больных были мужского пола - 16 (64%). 10 (40%) пациентам была выполнена эмболизация верхней щитовидной артерии, из них 8 - билатерально, 2 - унилатерально. 9 (36%) больным была выполнена билатеральная эмболизация верхнечелюстной артерии, 6 (24%) - билатеральная эмболизация язычной артерии. В качестве эмболизационного материала у 22 (88%) пациентов использовались сферические частицы ПВА размером от 150 до 700 мкм, а у 3 (12%) больных - гемостатическая губка и платиновые спирали.
Результаты. Эффективный гемостаз после эндоваскулярной эмболизации был достигнут у 23 (92%) пациентов. В 2 (8%) случаях кровотечение сохранялось, что потребовало проведение хирургической перевязки наружной сонной артерии. В связи с рецидивом кровотечения у 2 (8%) больных была выполнена повторная эндоваскулярная эмболизация. Все пациенты, у которых была выполнена эффективная эндоваску-лярная эмболизация, были выписаны из больницы в течение недели после вмешательства.
Выводы. Эндоваскулярная эмболизация способна обеспечить быстрый и эффективный гемостаз при кровотечении у пациентов с опухолями головы и шеи.
Непосредственные результаты эндоваскулярной эмболизации у пациентов с легочными кровотечениями Хайрутдинов Е.Р., Цуркан В.А., Араблинский А.В.
Отделение рентгенохирургических методов диагностики и лечения ГБУЗ “ГКБ имени С.П. Боткина, ДЗ г. Москвы" Кафедра терапии и подростковой медицины ГБОУ ДПО “РМАПО"
Цель исследования: оценить эффективность эндоваскуляр-ной эмболизации у пациентов с легочными кровотечениями.
Материал и методы. В период с января 2008 по май 2013 г. 53 больным с рецидивирующим легочным кровотечением, неэффективной гемостатической терапией и эндоскопическим гемостазом была выполнена ангиография бронхиальных артерий. Наиболее частой этиологической причиной легочного кровотечения был рак легкого - 24 (45,3%) больных, абсцесс легкого - 10 (18,9%) больных, бронхоэктатическая болезнь -9 (16,8%) больных, другие причины - 10 (18,8%) больных. Возраст больных колебался от 21 до 77 лет, средний возраст составил 54,3 ± 5,8 года. Большинство больных были мужского пола - 35 (66%). Эндоваскулярную эмболизацию легочного кровотечения удалось выполнить у 50 (96,2%) пациентов.

Эмболизация — малоинвазивная процедура, которая может дополнять хирургическое лечение или использоваться самостоятельно. Хирург через прокол в бедренной артерии проводит специальный катетер в артерии, непосредственно питающие опухоль и через него закрывает их специальными частицами — эмболами, которые перекрывают кровоток. В ряде случаев используют эмболы, способные выделять химиопрепарат в ткань опухоли — такое вмешательство называется химиоэмболизация.
Эмболизация применяется для лечения многих заболеваний. С начала XXI века эта процедура получает все более широкое применение и в онкологии, в первую очередь из-за своей эффективности и малоинвазивности — эмболизации безболезненны, не требуют наркоза, инструмент вводится через пункцию артерии, т. е. нет никакой операционной раны.
Эмболизация у онкологических пациентов
Эмболизация артерий для лечения опухолей и их метастазов помогает решить следующие задачи:
- в качестве самостоятельного метода лечения — эмболизация (чаще всего в варианте химиоэмболизации) может приводить к ишемии ткани опухоли и ее гибели. Для некоторых заболеваний, например, ряд опухолей печени, этот лечения может приводить к полной ремиссии без хирургического лечения.
- в сочетании с хирургическим лечением эмболизация используется как вспомогательная технология — чаще всего для уменьшения кровотечения во время операции за счет деваскуляризации (обескровливания) новообразования;
- в ряде случаев эмболизация, выполненная перед операцией, дает возможность проведения более радикальной операции за счет предварительного уменьшения опухоли;
- эмболизация также может применяться для борьбы с симптомами и осложнениями онкологических заболеваний — это в первую очередь остановка опасных кровотечений, которые угрожают жизни пациента, кроме того — облегчение боли, вызванной злокачественным новообразованием; еще одним эффектом является уменьшение объема и замедление роста опухоли.
Виды эмболизации артерий у онкологических больных:
- предоперационная — выполняется в качестве первого этапа хирургического вмешательства;
- в качестве самостоятельного метода лечения — чаще всего при опухолях печени, почек и ряде других опухолей
- в качестве паллиативного метода лечения — для остановки кровотечений, уменьшения болевого синдрома, уменьшения объемов и темпа роста опухоли.
Как проводится эмболизация артерий?
Эмболизация выполняется врачами-рентгенохирургами в специально оборудованной ангиографической операционной. Перед эмболизацией всегда проводят ангиографию. В сосуды вводят рентгенконтрастное вещество, в ходе чего записывают рентгеновское изображение в цифровом видеоформате. Это помогает врачу оценить расположение и анатомию сосудов, определить, из каких артерий осуществляется кровоснабжение опухоли.
Чаще всего эмболизацию выполняют под местной анестезией. В редких случаях приходится использовать общую анестезию (наркоз). За 4–5 часов до процедуры пациента просят ограничить прием пищи, иногда дают успокоительные препараты.
В большинстве случаев доступ к нужному сосуду получают через бедренную артерию, это самый типичный доступ для всех ангиографических исследований и вмешательств, но могут использовать и другие артерии в других местах (лучевую на запястье, плечевую в области локтевого сгиба и т. п.). Врач обрабатывает кожу антисептиком и делает небольшой прокол, вводит в артерию специальный катетер размером не более 1,5 мм и продвигает его до тех пор, пока не достигнет нужного сосуда. Через катетер в сосуд вводят эмболы, которые перекрывают его просвет.
Существуют разные виды эмболов:
- Поливинилалкоголь (PVA) представляет собой частицы размером от 50 до 1000 мкм. Это относительно недорогой и простой в применении препарат, однако, в настоящее время он считается устаревшим. Сейчас чаще всего применяют сферические эмболы, например, Bead Block и Embozene.
- Спирали из платины и нержавеющей стали. После установки в просвете сосуда на них быстро образуется тромб, который перекрывает кровоток. Иногда такие спирали применяют вместе с желатиновыми губками: сначала устанавливают спираль, а затем через катетер вводят губку — ее частички оседают между витками. Их применяют только для остановки кровотечений, обусловленных опухолями.
- Химиоэмболизация — введение в просвет сосуда эмболов, содержащих химиопрепарат. Таким образом, с одной стороны происходит закупорка сосудов, кровоснабжающих опухоль, а с другой химиопрепарат поступает непосредственно в ткань опухоли и не оказывает побочные эффекты, которые возникают при его введении в вену. При этом в самой опухоли создаются очень высокие концентрации препарата, невозможные при обычном введении. Мы применяем самые современные препараты для химиоэмболизации: DC Beads (Terumo, Япония) и Hepaspheres (Merit Medical, США)., которые высвобождают химиопрепарат в течение длительного времени, в стабильной дозировке.
- Радиоэмболизация — введение эмболов, содержащих радиоактивные изотопы. Эта процедура еще называется внутренней лучевой терапией, так как в опухоль изнутри вводят дозу радиации, разрушающей ее клетки. Для этого обычно используют изотоп Иттрий-90.
К эмболизации артерий наиболее часто прибегают при следующих онкологических заболеваниях:
- В качестве самостоятельного метода лечения: Первичные и метастатические опухоли печени, почек, легких и других локализаций.
- В комбинации с хирургическими методами: Первичные и метастатические опухоли печени, почек, легких, костей, позвоночника, матки, простаты, мочевого пузыря и т. д.
- Для остановки кровотечений при опухолях: малого таза, легких, прямой кишки, толстой кишки, печени, матки, простаты, опухолях головы и шеи. Т. е. практически при любой локализации с целью прекращения кровотечения.
Эмболизация также широко применяется для лечения заболеваний, не связанных с онкологией:
- Миома матки. Эмболизация маточных артерий — наименее травматичный способ лечения миомы матки, обладающий высокой эффективностью — около 98,5% женщин, перенесших эту процедуру, не нуждаются в дополнительном лечении.
- Аденома простаты. Эмболизация - эффективный, малоинвазивный способ лечения аденомы предстательной железы, который сегодня становится все более распространен в развитых странах.
- Варикоцеле — наименее инвазивная альтернатива хирургическому лечению, выполняется амбулаторно за 20–30 минут.
- Сосудистые мальформации различной локализации.
- Аневризмы — в первую очередь аневризмы головного мозга, способные вызвать геморрагический инсульт.
Насколько безопасна эмболизация?
Цель эмболизации в онкологии — не только прекратить приток крови к патологическому очагу, но и сохранить при этом кровообращение в соседних здоровых тканях. Современная техника эмболизации с использованием микрокатетеров позволяет обеспечить необходимую точность эмболизации.
Для того чтобы обеспечить точность в ходе эмболизации всегда проводят ангиографию. Врач внимательно изучает сосудистую сеть, кровоснабжение опухоли и определяет, в какой сосуд должны быть введены эмболы. Эмболы вводятся только после детального изучения сосудистой анатомии опухоли в ходе вмешательства. Перед эмболизацией вам также могут назначить УЗИ, КТ, МРТ и другие исследования.
Существует ряд противопоказаний к проведению эмболизации, но все они являются относительными, то есть процедура, как правило, все же может быть проведена при соблюдении некоторых условий. Например, у пациента с нарушением функции почек должно быть нормализовано артериальное давление, водно-солевой баланс, а во время ангиографии нужно использовать минимальное количество контрастного вещества.
В Европейской клинике с каждым пациентом работают индивидуально. Врач оценивает общее состояние больного, учитывает сопутствующие заболевания, размеры и расположение опухоли, особенности ее кровоснабжения.
Врачи-специалисты Европейской клиники имеют огромный опыт проведения эмболизации артерий при различных видах опухолей. Мы используем значительный собственный и опыт коллег из ведущих зарубежных клиник. Некоторые процедуры, которые мы предлагаем пациентам в Европейской клинике (например, эмболизация при аденоме простаты), даже в Европе, США и Израиле являются прерогативой крупных университетских клиник из-за необходимости иметь хирургов самого высокого уровня.
Нашими врачами были выполнены первые в России эмболизации миомы матки, артерий простаты, мы первыми стали работать с самыми современными препаратами для эмболизации — Bead Block, Embozene, DC Bead и др.
Читайте также:


